Allylbutyrat
Allylbutyrat ist ein Carbonsäureester, der sich von Allylalkohol und Buttersäure ableitet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
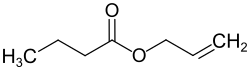
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Allylbutyrat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 128,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,902 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,414 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenAllylbutyrat kann durch Reaktion von Allylalkohol und Buttersäure in Gegenwart von konzentrierter Schwefelsäure oder p-Toluolsulfonsäure in Benzol gewonnen werden.[4]
Eigenschaften
BearbeitenAllylbutyrat inhibiert in Mäusen die Histon-Deacetylase und hemmt das Wachstum von erythroleukämischen Zellen.[5] Allylbutyrat stimuliert die Keimung von Teliosporen des Bohnenrosts.[6]
Reaktionen
BearbeitenIn einer radikalischen Polymerisation können Copolymere aus Vinylacetat und Allylbutyrat hergestellt werden.[7]
Verwendung
BearbeitenAllylbutyrat ist ein synthetischer, nach Äpfeln riechender Aromastoff.[8] In der EU ist es unter der FL-Nummer 09.054 als Aromastoff für Lebensmittel allgemein zugelassen.[9] Es wird auch als Aromastoff in Tierfutter verwendet.[10]
Toxikologie
BearbeitenDer orale LD50-Wert bei Ratten wurde zu 250 mg/kg Körpergewicht bestimmt. Die Vergiftung führt zu Abmagerung und Depressionen. Der Tod tritt nach einigen Studen bis mehreren Tagen ein.[11]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu ALLYL BUTYRATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. Februar 2024.
- ↑ a b c d e f g h Datenblatt Allylbuttersäure, >98%, FG bei Sigma-Aldrich, abgerufen am 4. Februar 2024 (PDF).
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics. (Special Student Edition). CRC-Press, 1995, ISBN 978-0-8493-0595-5, S. 690 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2004, ISBN 978-1-4200-3787-6, S. 1984 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michael A. Lea, Mariam Rasheed, Verrell M. Randolph, Faika Khan, Asif Shareef, Charles desBordes: Induction of Histone Acetylation and Inhibition of Growth of Mouse Erythroleukemia Cells by S-Allylmercaptocysteine. In: Nutrition and Cancer. Band 43, Nr. 1, Mai 2002, S. 90–102, doi:10.1207/S15327914NC431_11.
- ↑ Richard C. French, Susan E. Nester, J. Rennie. Stavely: Stimulation of germination of teliospores of Uromyces appendiculatus by volatile aroma compounds. In: Journal of Agricultural and Food Chemistry. Band 41, Nr. 10, Oktober 1993, S. 1743–1747, doi:10.1021/jf00034a042.
- ↑ Yasumasa Shigetomi, Takehiro Kojima, Naruhito Ono: Allylic polymers. I. Copolymerization of allyl esters with vinyl acetate. In: Journal of Polymer Science Part A: Polymer Chemistry. Band 28, Nr. 12, November 1990, S. 3317–3325, doi:10.1002/pola.1990.080281211.
- ↑ Susan M Barlow: Safety of Food Additives in Europe. In: Essential Guide to Food Additives. The Royal Society of Chemistry, 2013, ISBN 978-1-84973-560-5, S. 14–30.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 3. Februar 2024.
- ↑ William I Jones, Loretta A Roback, Jean M Taylor: The Loss of Food Flavors from Laboratory Animal Diets. II. Effect of Laboratory Environment. In: Journal of AOAC INTERNATIONAL. Band 54, Nr. 1, 1. Januar 1971, S. 42–46, doi:10.1093/jaoac/54.1.42.
- ↑ Jean M. Taylor, Paul M. Jenner, William I. Jones: A comparison of the toxicity of some allyl, propenyl, and propyl compounds in the rat. In: Toxicology and Applied Pharmacology. Band 6, Nr. 4, Juli 1964, S. 378–387, doi:10.1016/S0041-008X(64)80002-8.

