Dendrotoxine sind eine Gruppe von Proteinen und Neurotoxine, die von verschiedenen Mamba-Arten (Dendroaspis sp.) gebildet werden.
Eigenschaften
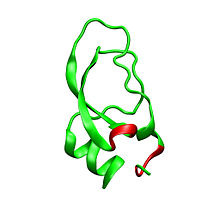
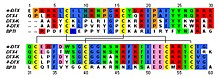
BearbeitenDendrotoxine sind Schlangengifte, die an spannungsgesteuerte Kaliumkanäle in Nervenzellen binden. Sie dienen den Mambas zur Lähmung ihrer Beute.[1] Sie sind zwischen 57 und 60 Aminosäuren lang und besitzen drei Disulfidbrücken und ein Molekulargewicht von circa 7 Kilodalton.[2] Dendrotoxine besitzen als typisches Strukturmotiv nahe dem N-Terminus ein Lysin, gefolgt von einer hydrophoben Aminosäure.[3] Auch bei nichtverwandten Toxinen von Wirbellosen mit dem gleichen Bindungsziel ist dieses Strukturmotiv zu finden, was als konvergente Evolution gedeutet wurde.[3] Die Dendrotoxine α-Dendrotoxin und Toxin I bindet an die Kaliumkanäle Kv1.1, Kv1.2 und Kv1.6, während Toxin K vor allem Kv1.1 bindet.[4]
Dendrotoxine besitzen strukturelle Ähnlichkeiten zu Proteasehemmern vom Kunitz-Typ wie Aprotinin, ohne die proteasehemmenden Eigenschaften aufzuweisen.[2] Im Gift der Wespen Eumenes pomiformis, Anoplius samariensis und Rhynchium brunneum befinden sich dem Dendrotoxin verwandte Toxine, EpDTX bzw. As-fr-19.[5]
Anwendungen
BearbeitenDendrotoxine werden zur indirekten Molekülmarkierung von spannungsgesteuerten Kaliumkanälen verwendet.[6]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ R. J. McCleary, R. M. Kini: Non-enzymatic proteins from snake venoms: a gold mine of pharmacological tools and drug leads. In: Toxicon: official journal of the International Society on Toxinology. Band 62, Februar 2013, S. 56–74, doi:10.1016/j.toxicon.2012.09.008, PMID 23058997.
- ↑ a b A. L. Harvey: Recent studies on dendrotoxins and potassium ion channels. In: General pharmacology. Band 28, Nummer 1, Januar 1997, S. 7–12, PMID 9112070.
- ↑ a b S. Gasparini, J. M. Danse, A. Lecoq, S. Pinkasfeld, S. Zinn-Justin, L. C. Young, C. C. de Medeiros, E. G. Rowan, A. L. Harvey, A. Ménez: Delineation of the functional site of alpha-dendrotoxin. The functional topographies of dendrotoxins are different but share a conserved core with those of other Kv1 potassium channel-blocking toxins. In: The Journal of biological chemistry. Band 273, Nummer 39, September 1998, S. 25393–25403, PMID 9738007.
- ↑ A. L. Harvey, B. Robertson: Dendrotoxins: structure-activity relationships and effects on potassium ion channels. In: Current medicinal chemistry. Band 11, Nummer 23, Dezember 2004, S. 3065–3072, PMID 15579000.
- ↑ S. H. Lee, J. H. Baek, K. A. Yoon: Differential Properties of Venom Peptides and Proteins in Solitary vs. Social Hunting Wasps. In: Toxins. Band 8, Nummer 2, Januar 2016, S. 32, doi:10.3390/toxins8020032, PMID 26805885, PMC 4773785 (freier Volltext).
- ↑ A. L. Harvey: Twenty years of dendrotoxins. In: Toxicon: official journal of the International Society on Toxinology. Band 39, Nummer 1, Januar 2001, S. 15–26, PMID 10936620.