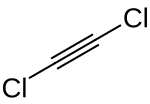
Dichlorethin ist eine organische Chlorkohlenstoffverbindung, die als chloriertes Derivat des Ethins angesehen werden kann.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dichlorethin | |||||||||||||||
| Andere Namen |
Dichloracetylen | |||||||||||||||
| Summenformel | C2Cl2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem, süßlichen Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 94,93 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,952 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
32 °C[1] | |||||||||||||||
| Löslichkeit |
löslich in Ethanol, Diethylether, Aceton[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,4 mg·m−3[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Geschichte
BearbeitenEine erste Erwähnung der Verbindung als Zwischenprodukt erfolgte im Jahr 1918 bei einer Synthese von Tolan mit den Ausgangsstoffen Calciumcarbid, Chlor und Benzol.[6] Die ersten Herstellungen wurden 1930 zum einen aus Trichlorethen in Gegenwart von Kaliumhydroxid und Calciumoxid bei 130 °C[7] und zum anderen aus Ethin und Chlor[8] beschrieben.
Gewinnung und Darstellung
BearbeitenEine Vielzahl von Darstellungsvarianten von Dichlorethin basieren auf der Einwirkung von Alkalihydroxiden bzw. Alkalilaugen auf Trichlorethen.[9] Die Dehydrohalogenierung von Trichlorethen gelingt auch mittels Lithium-bis(trimethylsilyl)amid bei −78 °C. Diese Synthese in Gegenwart von Diethylether ergibt ein stabileres 1:1-Addukt.[10] Eine Herstellung mit hoher Ausbeute kann durch die Umsetzung von Trichlorethen mit Kaliumhydrid in Gegenwart einer katalytischen Menge an Methanol in Tetrahydrofuran erfolgen.[11] Die direkte Chlorierung von Ethin gelingt mittels Kaliumhypochlorit.[12]
Die Pyrolyse von Dichlormaleinsäureanhydrid bei 850 °C ergibt ebenfalls die Verbindung.[13]
Eigenschaften
BearbeitenDichlorethin ist eine sehr flüchtige Flüssigkeit, die unter Normaldruck schon bei 32 °C siedet.[1] Die molare Verdampfungsenthalpie beträgt 27,4 kJ·mol−1[14] Mit einer molaren Bildungsenthalpie von 199 kJ·mol−1 handelt es sich um eine stark endotherme Verbindung[14], die zum explosiven Zerfall neigt und sich an der Luft spontan entzündet.[2][15] Eine stabile 1:1-Verbindung mit Diethylether mit einem Gehalt von 55,4 % Dichlorethin ist nicht explosiv und an der Luft stabil.[2][15][16]
Verwendung
BearbeitenDie Verbindung wird wegen der hohen gesundheitsschädlichen Wirkung und der chemischen Instabilität kommerziell nicht genutzt.[3] In der organischen Synthese kann das 1:1-Addukt mit Diethylether zur Einführung einer Vinyl-, Ethinyl- oder Dichlorvinylfunktion in organische Moleküle verwendet werden.[10] Die Umsetzung z. B. mit Imidazol ergibt das N-(1,2-Dichlorvinyl)-imidazol.[10]
Toxikologie
BearbeitenDer Stoff ist nach den Technischen Regeln für Gefahrstoffe (TRGS) 905 als krebserzeugend für den Menschen in der Kategorie K1B eingestuft.[1]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu Dichloracetylen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Februar 2020. (JavaScript erforderlich)
- ↑ a b c John Wotiz, Francis Huba, Robert Vendley: Notes- α-Chloroacetylenes. In: The Journal of Organic Chemistry. 26, Nr. 5, 1961, S. 1626–1627, doi:10.1021/jo01064a600.
- ↑ a b IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (Hrsg.): Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide (= IARC monographs on the evaluation of carcinogenic risks to humans. Band 71). World Health Organization, International Agency for Research on Cancer, Lyon 1999, ISBN 978-92-832-1271-3, S. 369–378 (iarc.fr).
- ↑ Eintrag zu dichloroacetylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7572-29-4 bzw. Dichlorethin), abgerufen am 2. November 2015.
- ↑ Clinton Davidson: Tolane chlorides from calcium carbide, chlorine and benzene. In: Journal of the American Chemical Society. 40, Nr. 2, 1918, S. 397–400, doi:10.1021/ja02235a009.
- ↑ Erwin Ott, Walter Ottemeyer, Kurt Packendorff: Über das Dichlor-acetylen. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 63, Nr. 8, 1930, S. 1941–1944, doi:10.1002/cber.19300630810.
- ↑ Patent DE495787: Verfahren zum Ersatz von Wasserstoff an dreifach gebundenem Kohlenstoff gegen Chlor und Brom. Veröffentlicht am 17. April 1930, Anmelder: IG Farben AG.
- ↑ Eintrag zu Trichlorethen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. November 2014.
- ↑ a b c Kende, A.S.; Fludzinski, P.: A Convenient Laboratory Synthesis of Dichloroacetylene. In: Synthesis. 1982, 455–456. doi:10.1055/s-1982-29831.
- ↑ Jean Noel Denis, Albert Moyano, Andrew E. Greene: Practical synthesis of dichloroacetylene. In: The Journal of Organic Chemistry. 52, Nr. 15, 1987, S. 3461–3462, doi:10.1021/jo00391a059.
- ↑ Fritz Straus, Leo Kollek, Walther Heyn: Über den Ersatz positiven Wasserstoffs durch Halogen. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 63, 1930, S. 1868–1885, doi:10.1002/cber.19300630739.
- ↑ R.M. Trifu: Homopolymers of Dihaloacetylenes. Dissertation, University of Illinois at Chicago 1999, ISBN 978-0-549-39503-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Jeffrey A. Manion: Evaluated Enthalpies of Formation of the Stable Closed Shell C1 and C2 Chlorinated Hydrocarbons. In: Journal of Physical and Chemical Reference Data. 31, Nr. 1, 2002, S. 123–172, doi:10.1063/1.1420703.
- ↑ a b P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 6. Edition, Vol. 1, Butterworth/Heinemann 1999, ISBN 0-7506-3605-X, S. 229.
- ↑ Erwin Ott: Über das Dichloracetylen, III. Mitteil.: Darstellung und einige Vorlesungsversuche mit der gefahrlos zu handhabenden Molekülverbindung mit Äther. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 75, Nr. 12, 1942, S. 1517–1522, doi:10.1002/cber.19420751215.

