Januskinasen (Abkürzung JAK) sind zytoplasmatische Tyrosinkinasen (spezielle Enzyme), welche unter anderem mit Zytokin-Rezeptoren assoziiert sind.[1]
Eigenschaften
BearbeitenDie JAK-Familie besteht bei Säugetieren aus den vier Proteinen JAK1, JAK2, JAK3 und TYK2.[2][3] Sie bestehen je aus über 1000 Aminosäuren und haben eine molare Masse von 120 bis 130 kDa. JAK1, JAK2 und TYK2 werden ubiquitär exprimiert, während die Expression von JAK3 auf Zellen der myeloischen und lymphoiden Abstammungslinien beschränkt ist.[3] Der Vergleich der JAK-Sequenzen zeigt sieben Regionen mit hoher Homologie (Janus-Homologiedomänen JH1 bis JH7).[3] JH1 ist die Domäne, die für die enzymatische Aktivität der JAK verantwortlich ist. JH2 stellt eine Pseudokinasedomäne dar, die für die katalytische Aktivität von JH1 erforderlich zu sein scheint. Die N-aminoterminale JAK-Region JH3 bis JH7 erstreckt sich über 550 Aminosäuren und ist an der Rezeptorassoziation beteiligt. Funktionell ist der N-terminale Bereich relativ divergent und scheint eine wichtige Rolle bei der Spezifität der Rezeptorbindung zu spielen.[3]
Funktion
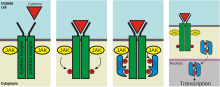
BearbeitenIm Gegensatz zu Rezeptor-Tyrosinkinasen besitzen die Zytokin-Rezeptoren 1 und 2 keine eigene Enzymaktivität und benötigen daher Januskinasen (welche ursprünglich als „Just Another Kinase“ bezeichnet wurde), um intrazelluläre Signalkaskaden zu aktivieren (JAK1 und JAK2). Beim Andocken eines Signalmoleküls an den Rezeptor werden die JAKs aktiviert und phosphorylieren sich daraufhin gegenseitig.
Im nun vorliegenden aktivierten Zustand können sie den sogenannten JAK-STAT-Signalweg aktivieren. JAKs phosphorylieren hierbei sogenannte STAT-Proteine (signal transducer and activator of transcription). Diese bewegen sich nun zum Zellkern, wo sie als Transkriptionsfaktoren die Transkription spezifischer Zielgene stimulieren können.
Über die JAK- und STAT-Proteine vermitteln viele Zytokine, Interferone und Interleukine, aber auch Erythropoetin, das Wachstumshormon (GH) sowie Prolaktin und Leptin ihre Signale.
Janus-Kinasen sind benannt nach dem doppelköpfigen römischen Gott Janus, dem Wächter der Tore, da sie zwei ähnliche Proteindomänen besitzen, von denen aber nur eine funktional ist.
Hemmung der Januskinasen
BearbeitenJanuskinasen lassen sich durch Januskinasen-Inhibitoren (JAK-Hemmer, JAKinibe) hemmen. Diese Substanzen, die somit zu den Kinasehemmern gehören, können sich in der Spezifität für das Zielprotein unterscheiden, so dass man je nach Selektivität unterscheidet in JAK1-Hemmer, JAK2-Hemmer usw. Anders als die hochmolekularen Biologika können sie oral verabreicht (eingenommen) werden. Zu der Stoffgruppe gehören u. a. die folgenden Substanzen, die insbesondere im Bereich von immunologischen, chronisch-entzündlichen und hämatologischen Erkrankungen zur Anwendung kommen:
- Ruxolitinib wird zur Behandlung der Myelofibrose eingesetzt.[4][5]
- Tofacitinib (Handelsname: Xeljanz; Hersteller: Pfizer) ist EU-weit zugelassen zur Behandlung der moderaten bis schweren rheumatoiden Arthritis (Mai 2017),[6] der Psoriasisarthritis (Juni 2018),[7] der schweren Colitis ulcerosa (Juli 2018),[8] der juvenilen idiopathischen Arthritis (August 2021) und der ankylosierenden Spondylitis (November 2021).[9] Auch in der Behandlung von COVID-19 wurde Tofacitinib in einer brasilianischen Studie untersucht, in welcher es in Kombination mit einem Glukokortikosteroid die Letalität bei hospitalisierten Patienten senkte.[10]
- Upadacitinib (Rinvoq, Hersteller: AbbVie) ist in den USA seit August 2019 und in der EU seit Dezember 2019[11] zugelassen zur Behandlung der rheumatoiden Arthritis. Zulassungserweiterungen betreffen die Behandlung der Psoriasisarthritis (Januar 2021), der ankylosierenden Spondylitis (Januar 2021), die atopische Dermatitis (August 2021)[12] sowie mittelschwerer bis schwerer aktiver Colitis ulcerosa (2022)[13].
- Filgotinib (Hersteller: Gilead Sciences) wurde im September 2020 in der Indikation Rheumatoide Arthritis in der EU zugelassen.[14] Auch die Indikationen Morbus Crohn und Colitis ulcerosa werden für Filgotinib untersucht.
- Oclacitinib ist beim Hund zur Behandlung der atopischen Dermatitis[15] sowie des mit allergischer Dermatitis einhergehenden Juckreizes zugelassen.[16]
- Itacitinib ist ein Inhibitor, der selektiver und stärker JAK1 als JAK2 hemmt.[17] Für die Behandlung von Graft-versus-Host-Reaktionen hat die Substanz einen Status als Orphan-Arzneimittel.[18]
- Pacritinib ist seit 2022 in den USA zur Behandlung der Myelofibrose zugelassen.
- Baricitinib ist in der Europäischen Union seit 2017, in den USA seit 2018, zugelassen zur Behandlung von mittelschwerer bis schwerer aktiver rheumatoider Arthritis, ferner seit 2020 in der EU zur Behandlung der atopischen Dermatitis (Neurodermitis), seit 2022 zur Behandlung der schwerwiegenden Alopecia areata. Die WHO empfiehlt Baricitinib seit Januar 2022 zur Kombinationsbehandlung von COVID-19-Erkrankten mit schwerem Verlauf.
- Abrocitinib ist in der Europäischen Union seit 2021 zur Behandlung der mittelschweren bis schweren atopischen Dermatitis (Neurodermitis) zugelassen.[19]
- Fedratinib ist in der Europäischen Union seit 2021 zur Behandlung krankheitsbedingter Splenomegalie oder Symptomen bei erwachsenen Patienten mit primärer Myelofibrose, Post-Polycythaemia Vera-Myelofibrose oder Post-Essentieller Thrombozythämie-Myelofibrose zugelassen, wenn diese Patienten vorher nicht schon mit einem anderen JAK-Inhibitor therapiert wurden. Es hemmt selektiv JAK2 und die FMS-ähnliche Tyrosinkinase 3 (FLT3).[20]
Anders als bei den biotechnologisch hergestellten TNF-alpha-Antagonisten besteht bei der Behandlung mit Januskinase-Hemmern ein erhöhtes Risiko für eine Reaktivierung einer Infektion mit dem Varizella-Zoster-Virus (Gürtelrose, Herpes zoster). In einer Metaanalyse kam es zu 3,2 Infektionen pro 100 Patientenjahren. Das relative Risiko betrug für Tofacitinib 2,0, für Baricitinib 3,2 und für Upadacitinib 3,0, ohne dass der genaue Mechanismus bekannt ist. Daher wird eine Schutzimpfung vor Therapieeinleitung empfohlen.[21] Ebenso ist eine Reaktivierung des Cytomegalievirus zu beobachten, in einer Phase-III-Studie mit Ruxolitinib in 26 % gegen 21 % in der Kontrollgruppe.[22]
Im November 2022 veröffentlichte die Europäische Arzneimittel-Agentur (EMA) Empfehlungen zur Vermeidung schwerer Nebenwirkungen von JAK-Inhibitoren, darunter Herz-Kreislauf-Erkrankungen, Blutgerinnsel, Krebs und schwere Infekte. Demnach sollen JAK-Inhibitoren bei älteren Patienten (ab 65 Jahren), Rauchern oder ehemaligen starken Rauchern sowie Patienten mit erhöhtem Krebs- oder Herz-Kreislauf-Risiko nur noch dann eingesetzt werden, wenn keine anderen Medikamente geeignet oder verfügbar sind. Bei Patienten mit Risiko für Blutgerinnsel sollen sie nur mit Vorsicht eingesetzt werden.[23] Grundlage dieser Empfehlungen sind vor allem die Ergebnisse einer randomisierten Studie, die ein erhöhtes Krebs- und Herz-Kreislauf-Risiko unter dem JAK-Inhibitor Tofacitinib zeigte.[24]
Weblinks
Bearbeiten- Neue Wirkstoffe für viele Indikationen (Artikel über JAK-Inhibitoren von W. Kathmann in der Pharmazeutischen Zeitung im Mai 2013)
- Facettenreiche Januskinase-Inhibitoren (Artikel über JAK-Inhibitoren von S. Oswald in der Deutschen Apothekerzeitung im August 2020)
- Anja Möricke: Identifizierung und Charakterisierung einer alternativ gespleißten mRNA der Interleukin-4 Rezeptor alpha-Kette und Untersuchung der biologischen Funktion der verkürzten Rezeptorvariante (Dissertation, Universität Berlin)
Quellen
Bearbeiten- ↑ Joachim Rassow et al.: Duale Reihe – Biochemie, Thieme, 1. Auflage 2006, Stuttgart, Seite 562 (ISBN 3-13-125351-7).
- ↑ Jak family tyrosine kinases (JAK) in der HGNC-Datenbank (Human Gene Nomenclature Committee), abgerufen am 5. März 2022.
- ↑ a b c d T. Kisseleva, S. Bhattacharya, J. Braunstein, C. Schindler: Signaling through the JAK/STAT pathway, recent advances and future challenges. Gene, Bd. 285, Nr. 1–2, 2002, S. 1–24. doi:10.1016/s0378-1119(02)00398-0
- ↑ C. Keohane, D. H. Radia, C. N. Harrison: Treatment and management of myelofibrosis in the era of JAK inhibitors. In: Biologics. Band 7, 2013, S. 189–198. doi:10.2147/BTT.S34942 PMID 23990704.
- ↑ M. Kogler: Ruxolitinib bei der Behandlung der Chronischen idiopathischen Myelofibrose. In: Klinik und Forschung, Band 19, Nr. 1, 2013, S. 67.
- ↑ Zusammenfassung des EPAR für die Öffentlichkeit, EPAR der EMA, abgerufen am 14. Juni 2018.
- ↑ XELJANZ® (tofacitinib citrate) Receives Marketing Authorisation in the European Union for Active Psoriatic Arthritis ( vom 4. Juli 2018 im Internet Archive), PM Pfizer vom 28. Juni 2018, abgerufen am 4. Juli 2018.
- ↑ Summary of opinion (post authorisation) ( vom 14. Juni 2018 im Internet Archive), PM EMA vom 31. Mai 2018 (englisch), abgerufen am 14. Juni 2018.
- ↑ Xeljanz Procedural steps taken and scientific information after the authorisation
- ↑ Guimarães, P.O. et al. (STOP COVID = Study of tofacitinib in hospitalized patients with Covid-19 pneumonia): N. Engl. J. Med. 2021, 385, 406, doi: 10.1056/NEJMoa2101643 (zitiert nach: Der Arzneimittelbrief 55, 8 (August 2021))
- ↑ Rinvoq EPAR, abgerufen am 5. März 2022.
- ↑ European Commission Approves RINVOQ® (upadacitinib) as First JAK Inhibitor in the European Union for the Treatment of Both Adults and Adolescents with Moderate to Severe Atopic Dermatitis, PM abbvie vom 24. August 2021, abgerufen am 28. August 2021
- ↑ Upadacitinib (Rinvoq) bei Colitis ulcerosa. In: gesundheitsinformation.de. 1. Dezember 2022, abgerufen am 3. Juni 2024.
- ↑ Jyseleca, abgerufen am 7. Oktober 2020.
- ↑ Chiara Noli: Atopische Dermatitis beim Hund – aktuelle Therapieansätze. In: Der Praktische Tierarzt. Band 96, Nr. 10, 2015, S. 996–1007.
- ↑ Apoquel (EPAR). Abgerufen am 5. März 2022.
- ↑ Nelson Chao: Finally, a Successful Randomized Trial for GVHD New England Journal of Medicine 2020, Band 382, Ausgabe 19 vom 7. Mai 2020, Seiten 1853–1854, DOI: 10.1056/NEJMe2003331
- ↑ Eintrag EU/3/17/1964 im EU-Register für Orphan-Arzneimittel, Europäische Kommission. Abgerufen am 5. März 2022.
- ↑ Cibinqo, EMA, 14. Oktober 2021.
- ↑ Fedratinib|Inrebic®|86|2021. In: Pharmazeutische Zeitung. Abgerufen am 6. Januar 2024.
- ↑ Florian Prechter, Matthias Pletz, Ulf Müller-Ladner, Andreas Stallmach: Therapie mit Wermutstropfen: Reaktivierung von Herpes zoster. Deutsches Ärzteblatt 2019, Jahrgang 116, Heft 35-36 vom 2. September 2019, Seiten A1541-1542
- ↑ Robert Zeiser, Nikolas von Bubnoff, Jason Butler, Mohamad Mohty, Dietger Niederwieser, Reuven Or, Jeff Szer, Eva M. Wagner, Tsila Zuckerman, Bruyère Mahuzier, Judith Xu, Celine Wilke, Kunal K. Gandhi, Gérard Socié et al. für die "REACH2 Trial Group": Ruxolitinib for Glucocorticoid-Refractory Acute Graft-versus-Host Disease. New England Journal of Medicine 2020, Band 382, Ausgabe 19 vom 7. Mai 2020, Seiten 1800–1810, DOI: 10.1056/NEJMoa1917635
- ↑ EMA confirms measures to minimise risk of serious side effects with Janus kinase inhibitors for chronic inflammatory disorders. Europäischen Arzneimittelagentur (EMA), 11. November 2022, abgerufen am 17. Januar 2023.
- ↑ Ytterberg SR, Bhatt DL, Mikuls TR et al.: Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. In: N Engl J Med. Band 386, Nr. 4, 27. Januar 2022, S. 316–326, doi:10.1056/NEJMoa2109927, PMID 35081280.