Lewy-Körper-Demenz
| Klassifikation nach ICD-10 | |
|---|---|
| G31.82 | Lewy-Körper-Demenz |
| ICD-10 online (WHO-Version 2019) | |
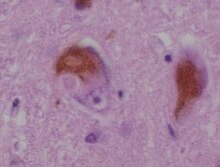
Die Lewy-Körper-Demenz, Lewy-Körperchen-Demenz oder auch Lewy-Body-Demenz (LBD) ist nach dem Morbus Alzheimer die zweithäufigste neurodegenerative Demenz im Alter. Sie kann als eigenständige Erkrankung auftreten oder sekundär im Rahmen einer bereits bestehenden Parkinson-Krankheit.
Geschichte
BearbeitenBenannt ist die Erkrankung nach dem deutsch-amerikanischen Neurologen Friedrich H. Lewy (1885–1950).[1] In seinem Buchkapitel über die „Paralysis agitans“ (heute Morbus Parkinson)[2] beschrieb er erstmals die später nach ihm benannten Lewy-Körperchen. Während seiner Tätigkeit an der Berliner Charité fand er diese Veränderungen im Nucleus basalis Meynert und Nucleus dorsalis nervi vagi von Parkinson-Patienten.[3]
Einteilung
Bearbeiten- diffuse Lewy-Körperchen-Erkrankung bzw. Demenz mit Lewy-Körperchen
- Morbus Parkinson mit begleitender Alzheimer-Pathologie
- Lewy-Körperchen-Variante des Morbus Alzheimer
Eine klare Differenzierung kann oft erst post mortem mit der histologischen Untersuchung der Veränderungen im Gehirn getroffen werden.
Die Einteilung in die Gruppe Demenz mit Vorliegen diffuser kortikaler Lewy-Körperchen erfolgte längere Zeit nach den Konsensus-Kriterien für eine Lewy-Body-Erkrankung (McKeith et al. 1996),[4] die besagen, dass mindestens zwei der folgenden drei Kriterien erfüllt sein müssen:
- fluktuierende kognitive Defizite (besonders Aufmerksamkeit)
- wiederholte detaillierte visuelle Halluzinationen
- extrapyramidalmotorische Störungen (unwillkürliche motorische Störungen)
Pathogenese
BearbeitenDie Lewy-Körperchen, welche auch diese Erkrankung ausmachen, wurden zuerst bei der Parkinsonerkrankung entdeckt. Es handelt sich hierbei um eosinophile Einschlüsse im Zytoplasma von Nervenzellen (Neuronen) in der Großhirnrinde und im Hirnstamm. Diese Einschlüsse sind anomale Aggregate von Protein, die die Bildung des Neurotransmitters Dopamin verringern, wodurch es unter anderem zu den typischen Parkinson-Symptomen kommt.
Nach der α-Synuclein-Pathologie ist heute post mortem eine neuropathologische Einteilung in vier Stadien üblich.[5]
Klinik
BearbeitenDie Lewy-Body-Demenz zeichnet sich typischerweise durch starke Schwankungen der Symptomatik aus. Aufmerksamkeit, Konzentrationsvermögen, Wachheit (Vigilanz) und andere kognitive Leistungen können tagesformabhängig variieren. Die Gedächtnisleistungen sind zu Krankheitsbeginn meist gut erhalten. Die Erkrankung verläuft progredient.
Kernsymptome
Bearbeiten- Fluktuation der kognitiven Leistung (wie obenstehend)
- visuelle Halluzinationen (welche die Patienten oft detailliert wiedergeben können)
- parkinsonähnliche Symptomatik
Häufige Symptome
Bearbeiten- Störungen des REM-Schlafes, oftmals wird das motorische Ausagieren von Träumen beobachtet (fehlende motorische Inhibition)
- hohe Empfindlichkeit auf Neuroleptika, paradoxe Reaktionen (z. B. erhöhte Aggressivität)
Weitere Symptome
Bearbeiten- Synkopen und Stürze
- Depression und Wahn
Diagnose
BearbeitenDie klinische Diagnose wird anhand der aktuellen Konsensuskriterien nach McKeith et al. gestellt.[7] Kriterien zur klinischen Diagnose der Demenz mit Lewy-Körperchen (DLB; gekürzt nach McKeith et al.): sind zwei der Kernmerkmale erfüllt, spricht man von einer wahrscheinlichen DLB, bei einem Kernmerkmal von einer möglichen DLB.
Obligates Merkmal: Zunehmende kognitive Störungen, die mit Beeinträchtigungen im sozialen oder beruflichen Umfeld einhergehen.
Kernmerkmale: Kognitive Fluktuationen, vor allem der Aufmerksamkeit, wiederkehrende, meist detailreiche visuelle Halluzinationen, motorische Parkinson-Symptome
Hinweisende Merkmale: Stürze, Synkopen, vorübergehende Störungen des Bewusstseins, Halluzinationen in anderen Sinnesmodalitäten, Wahn, REM-Schlaf-Verhaltensstörungen, Neuroleptika-Sensitivität, mittels SPECT- oder PET-Bildgebung erfasste, verminderte Dopamin-Transporter-Aufnahme im Striatum (SPECT = Single photon emission computed tomography (Einzelphotonen-Emissions-Tomographie), PET = Positronen-Emissions-Tomographie, REM= Rapid eye movement).
Differentialdiagnose zum Morbus Alzheimer (AD): Visuelle Halluzinationen haben eine hohe Spezifität zur Unterscheidung zwischen LBD und AD (99 %), die visuokonstruktiven Einschränkungen eine hohe Sensitivität (74 %).[8] Auch kognitive Fluktuationen sprechen für LBD und gegen AD.[9]
Therapie
BearbeitenMedikamentöse Therapie ist immer nur symptomatisch. Da davon ausgegangen wird, dass bei dementiellen Erkrankungen pathophysiologisch ein Mangel an Acetylcholin besteht, wird therapeutisch dagegen angegangen, indem man das Enzym hemmt, das Acetylcholin abbaut. Diese Acetylcholinesterase-Hemmstoffe wie Rivastigmin, Donepezil oder Galantamin, die in Deutschland allerdings nur für die Alzheimer-Demenz zugelassen sind, stellen eine mögliche Therapieform dar. Die Therapie sollte im Allgemeinen früh begonnen werden, da sie den Verlauf nur bremsen, aber nicht rückgängig machen kann. Die Wirkungen ließen sich bisher nur in Studien und aufwändigen Testsystemen nachweisen. Für den Patienten und dessen Angehörigen sind diese Wirkungen nicht immer spürbar und haben nicht immer einen Einfluss auf deren Alltag. Bei der Lewy-Körperchen-Demenz ist jedoch sehr oft eine klinische Besserung zu beobachten, insbesondere auch optische Halluzinationen betreffend, vor allem in frühen Stadien.
Neuroleptika sind eher ungeeignet, da die Patienten meist verstärkt mit Nebenwirkungen darauf reagieren. Wenn dennoch Neuroleptika indiziert sind, können sogenannte atypische Neuroleptika versucht werden, die aber prinzipiell keine Vorteile aufweisen.
Teilweise werden auch nicht-pharmakologische Interventionen bei Verhaltensstörungen von Demenzkranken favorisiert.[10]
Weblinks
Bearbeiten- der Deutschen Gesellschaft für Neurologie – aufgerufen am 8. September 2018
- Wegweiser Demenz des Bundesministeriums für Familie, Senioren, Frauen und Jugend – aufgerufen am 3. Mai 2020
Einzelnachweise
Bearbeiten- ↑ Friedrich H. Lewy. Auf: www.whonamedit.com
- ↑ F. H. Lewy. „Paralysis agitans. I. Pathologische Anatomie“. In: M. Lewandowsky (Hrsg.): Handbuch der Neurologie. Berlin: Springer Verlag 1912, 920–933.
- ↑ Holdorff B. Friedrich: Heinrich Lewy (1885–1950) and his work. Journal of the History of the Neurosciences (J Hist Neurosci) 2002;11(1):19–28.
- ↑ McKeith et al. Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): report of the consortium on DLB international workshop. Neurology. 1996 Nov;47(5):1113–24.
- ↑ McKeith I et al.: Diagnosis and management of dementia with Lewy bodies. Neurology 2005;65:1863–72.
- ↑ Stechl, E., Knüvener, C. et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. 1. Auflage. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0, S. 222 f.
- ↑ McKeith et al.: Diagnosis and management of dementia with Lewy bodies. Neurology 2005; 65:1863–1872.
- ↑ P. Tiraboschi, D. P. Salmon, L. A. Hansen, R. C. Hofstetter, L. J. Thal, J. Corey-Bloom: What best differentiates Lewy body from Alzheimer's disease in early-stage dementia? Brain, März 2006, 129(3): 729-735, 2006; doi:10.1093/brain/awh725.
- ↑ Fermann TJ et al. DLB fluctuations. Neurology 2004; 62:181–187
- ↑ Cohen-Mansfield J.: Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. The American Journal of Geriatric Psychiatry (Am J Geriatr Psychiatry). 2001 Fall;9(4):361–381.