Plutonium(IV)-oxid, meistens als Plutoniumdioxid bezeichnet, ist das chemisch stabilste Oxid des Plutoniums. Es ist ein kristalliner gelb-brauner Feststoff mit hoher Schmelztemperatur.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
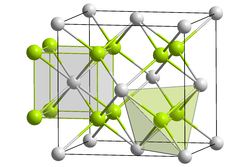
| |||||||||||||||||||
| _ Pu4+ _ O2− | |||||||||||||||||||
| Kristallsystem | |||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||||||||
| Gitterparameter |
a = 540 pm | ||||||||||||||||||
| Koordinationszahlen |
Pu[8], O[4] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Plutonium(IV)-oxid | ||||||||||||||||||
| Andere Namen |
Plutoniumdioxid | ||||||||||||||||||
| Verhältnisformel | PuO2 | ||||||||||||||||||
| Kurzbeschreibung |
gelbbraune kubische Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 276,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
11,5 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
2800 °C[2] | ||||||||||||||||||
| Löslichkeit |
schwer löslich in Säuren[3] | ||||||||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||||||||
 Radioaktiv | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eigenschaften
BearbeitenPlutoniumdioxid ist wenig reaktiv und wird von Wasser oder salzhaltigem Wasser fast nicht angegriffen. Es kann auch zu keramischem Material gesintert werden.
Plutoniumdioxid weist ein kubisches Kristallsystem auf, hat die Raumgruppe Fm3m (Nr. 225), die Elementarzellen haben als Gitterparameter a = 540 pm, der Strukturtyp ist der CaF2-Typ (Fluorit) und die Koordinationszahlen sind Pu[8], O[4].
Plutoniumdioxid ist ein olivgrünes bis graugrünes Pulver. Einkristalle, die sich zum Beispiel aus der Schmelze oder aus der Zersetzung von Plutonium(IV)-sulfat gewinnen lassen, liegen als schwarze glänzende Kristalle vor. Mikrokugeln, die sich durch Einschmelzen von Plutoniumdioxid-Pulver in einer Plasmaflamme darstellen lassen, sind rotbraun bis bernsteingelb.[3]
Darstellung
BearbeitenPlutoniumdioxid entsteht spontan durch die Oxidation von Plutoniummetall in einer oxidierenden Atmosphäre bei Normaltemperatur und -druck.
Bei der Wiederaufarbeitung von Kernbrennstäben wird es gewonnen, indem Plutonium(IV)-oxalat Hexahydrat oder Decahydrat bei Temperaturen ab 1000 °C kalziniert wird. Auch beim Erhitzen von Plutonium(IV)-nitrat und Plutoniumperoxid entsteht es.[3]
Verwendung
BearbeitenGesintertes Plutoniumdioxid wird in Radionuklid-Heizelementen und Radionuklidbatterien[5][6] verwendet und als Material für Brennstäbe in Atomreaktoren eingesetzt.
Sicherheitshinweise
BearbeitenEinstufungen nach der CLP-Verordnung liegen nicht vor, obwohl die chemische Giftigkeit von Plutonium bekannt ist. Wichtig sind die auf der Radioaktivität beruhenden Gefahren. Plutoniumdioxid ist je nach Art der verwendeten Plutoniumisotope unterschiedlich radioaktiv und durch die beim radioaktiven Zerfall entstehende Wärme bei kurzlebigen Alphastrahlern auch heiß.
Es gibt eine Studie über die möglichen Gefahren, die durch die Radionuklidbatterie und das enthaltene Plutoniumdioxid auf der Raumsonde New Horizons bestehen.[7][8]
Einzelnachweise
Bearbeiten- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-81.
- ↑ Plutoniumdioxid bei www.webelements.com.
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1305.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Tilmann Althaus: „Cassini und die Nuklearenergie“, in: Sterne und Weltraum, 1998, 37 (3), S. 220–223.
- ↑ saturn.jpl.nasa.gov: Environmental Effects of Plutonium Dioxide ( vom 29. September 2006 im Internet Archive) (PDF; 30 kB).
- ↑ National Aeronautics and Space Administration (Hrsg.): Final Environmental Impact Statement for the New Horizons Mission. Volume 1, Juli 2005 (jhuapl.edu [PDF]).
- ↑ National Aeronautics and Space Administration (Hrsg.): Final Environmental Impact Statement for the New Horizons Mission. Volume 2, Juli 2005 (jhuapl.edu [PDF]).
Literatur
Bearbeiten- David L. Clark, Siegfried S. Hecker, Gordon D. Jarvinen, Mary P. Neu: Plutonium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 813–1264 (doi:10.1007/1-4020-3598-5_7).