Stickstofftrichlorid (auch Trichloramin) ist eine explosive chemische Verbindung, die zur Gruppe der Stickstoffhalogenide und Chloramine gehört.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Stickstofftrichlorid | |||||||||||||||||||||
| Andere Namen |
Trichloramin | |||||||||||||||||||||
| Summenformel | NCl3 | |||||||||||||||||||||
| Kurzbeschreibung |
zähe[1], gelbe, chlorartig riechende, explosive Flüssigkeit[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 120,36 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,64 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
71 °C[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 0,06 ml·m−3 bzw. 0,3 mg·m−3[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Geschichte
Bearbeiten1811 experimentierte der französische Chemiker Pierre Louis Dulong mit Chlorgas und einer Lösung von Ammoniumchlorid, wobei sich Stickstofftrichlorid bildete. Bei seinen Experimenten mit der gefährlichen Verbindung kam es zu einer Explosion, bei der Dulong drei Finger verlor, was ihn dazu anregte, den Stoff weiter zu untersuchen. Nach dem Bekanntwerden des Unfalls beschäftigte sich 1813 auch der britische Chemiker Humphry Davy mit der Substanz. Später wurden andere Herstellungsverfahren von Balard sowie Böttger und Kolbe gefunden.[8]
Vorkommen
BearbeitenBei der Desinfektion mit Chlor in Schwimmbädern entsteht durch die Reaktion mit Harnstoff aus menschlichen Ausscheidungen als Nebenprodukt Stickstofftrichlorid. Das Stickstofftrichlorid ist für den typischen Geruch nach Chlor in Hallenbädern verantwortlich, der zeitweilig bei einer zu starken Belastung des Badebeckenwassers auftreten kann.[9]
Gewinnung und Darstellung
BearbeitenStickstofftrichlorid wird durch Chlorieren einer gesättigten, sauren Ammoniumchlorid-Lösung gebildet, wobei als Zwischenprodukte Chloramin und Dichloramin entstehen.
Eine etwa 1,4-molare Lösung von Stickstofftrichlorid in Tetrachlorkohlenstoff ist durch Einleiten von Chlorgas in eine mit Tetrachlorkohlenstoff unterschichtete Ammoniumcarbonat-Lösung zugänglich.[10]
Weiterhin kann Stickstofftrichlorid aus Calciumhypochlorit und Ammoniumchlorid in Gegenwart von Salzsäure in Methylenchlorid und Wasser gewonnen werden, wobei es dann aus der organischen Phase isoliert werden kann.[11]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenUnter Einwirkung von UV-Strahlung im UVB-Bereich bei 340 nm zersetzt sich Stickstofftrichlorid[12] durch Reaktion mit freien Hydroxidionen:
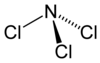
Wie Ammoniak besitzt Stickstofftrichlorid eine pyramidale Molekülstruktur mit einem Cl-N-Cl-Winkel von 107,78° und einer Schenkellänge (N–Cl) von 175,3 pm.
Chemische Eigenschaften
BearbeitenMit Wasser wird Stickstofftrichlorid zu Ammoniak und Hypochloriger Säure (HClO) hydrolysiert (da Stickstoff aufgrund der stark polarisierten Atombindungen in dieser Verbindung etwas elektronegativer ist als Chlor).[13]
Verwendung
BearbeitenBis etwa 1950 wurde ein großer Teil des Mehls mit Stickstofftrichlorid gebleicht („Agene-Prozess“).[14] Dies führt jedoch zur Bildung von Methioninsulfoximid, einem giftigen Derivat der Aminosäure Methionin, weswegen dieses Verfahren verboten wurde.[15]
Sicherheitshinweise
BearbeitenStickstofftrichlorid reizt die Augen, Atemwege und Schleimhäute.[1] Die metastabile Verbindung explodiert bei Temperaturerhöhung. Lösungen mit einer Konzentration bis zu 18 Prozent gelten als ungefährlich.[10]
Studien aus dem Jahr 1983 mit Ratten zeigten einen LC50-Wert von 112 ppm/1h bei Aufnahme über die Atemwege. Aufgetretene Symptome bei den Tieren waren erhöhter Tränenfluss, Krämpfe und organische und funktionale Störungen der Speicheldrüsen.[6][7]
Ende 2010 wurde im Bundesgesundheitsblatt der Verdacht geäußert, dass in gechlortem Beckenwasser entstandenes Stickstofftrichlorid beim Babyschwimmen Asthma auslösen kann. Insbesondere für Kinder unter zwei Jahren, in deren Familien gehäuft Allergien auftreten, rät das Umweltbundesamt so lange vom Babyschwimmen ab, bis weitere Erkenntnisse vorliegen, die für eine Unbedenklichkeit sprechen.[16]
Einzelnachweise
Bearbeiten- ↑ a b Eintrag zu Stickstofftrichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Februar 2017. (JavaScript erforderlich)
- ↑ a b webelements.com: Stickstofftrichlorid
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10025-85-1 bzw. Stickstofftrichlorid), abgerufen am 2. November 2015.
- ↑ a b American Industrial Hygiene Association Journal. Vol. 44, 1983, Pg. 145.
- ↑ a b Eintrag zu Nitrogen chloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Lateral Science: Fulminating oils
- ↑ Wasser, Trinkwasser und Gewässerschutz - Schwimm- und Badebeckenwasser - Chemie & Analytik ( vom 12. Februar 2013 im Webarchiv archive.today).
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 462.
- ↑ e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Trichloramine, abgerufen am 26. Juli 2017.
- ↑ Fachartikel: Energie- und Wassersparkonzepte für Schwimmbäder (PDF).
- ↑ T. M. Klapötke, H.-J. Meyer, C. Janiak, E. Riedel: Moderne anorganische Chemie., 2003, Walter de Gruyter, ISBN 3-11-017838-9, S. 75.
- ↑ Ludwig Acker: Handbuch der Lebensmittelchemie. Kohlenhydratreiche Lebensmittel. Springer-Verlag, 1967, ISBN 978-3-662-34537-5 (Google Books).
- ↑ C.A. Shaw, J.S. Bains: Did consumption of flour bleached by the agene process contribute to the incidence of neurological disease? In: Medical Hypotheses. Band 51, Nr. 6, Dezember 1998, S. 477, doi:10.1016/s0306-9877(98)90067-6 (englisch).
- ↑ Babyschwimmen und Desinfektionsnebenprodukte in Schwimmbädern. (PDF; 132 kB) Bundesgesundheitsblatt 01/2011, 54:142–144, 29. Dezember 2010 (online publiziert). doi:10.1007/s00103-010-1177-x.