Amphetamin (auch: Phenylisopropylamin oder Amfetamin) ist eine synthetische chemische Verbindung aus der Stoffgruppe der Phenylethylamine und zählt dort zu den Weckaminen (Amine mit „aufweckender“ Wirkung). Es wird in der Medizin als Arzneistoff zur Behandlung der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) und der Narkolepsie verwendet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
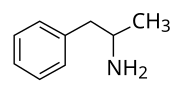
| ||||||||||||||||||||||
| Vereinfachte Strukturformel von Amphetamin ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Amfetamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H13N | |||||||||||||||||||||
| Kurzbeschreibung |
Amin-artig riechende, scharf schmeckende Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
indirektes Sympathomimetikum | |||||||||||||||||||||
| Wirkmechanismus |
Noradrenalin/Dopamin-Freisetzung | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 135,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,93 g·cm−3[1] | |||||||||||||||||||||
| Siedepunkt |
200–203 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
10,13[3] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,518 (26 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Amphetamin hat eine stark stimulierende und aufputschende Wirkung. Wie alle Amphetaminderivate und viele Stimulanzien wirkt es appetitzügelnd und in hohen Dosen euphorisierend. Daher ist es insbesondere in der Drogenszene beliebt und unter Bezeichnungen wie Speed oder Pep weit verbreitet.
Amphetamin ist die Stammverbindung der Substanzklasse der Amphetamine. Zu ihr gehören etliche weitere psychoaktive Substanzen, unter anderem Methamphetamin und das in der Natur vorkommende Ephedrin. Amphetamin ist ein Stimulans und indirektes Sympathomimetikum, d. h., es regt die sympathischen Teile des vegetativen Nervensystems an.
Es existieren zwei verschiedene Enantiomere des Amphetamins: D-Amphetamin und L-Amphetamin. Medizinisch wird oft reines D-Amphetamin verwendet, da dieses stärker wirksam ist als L-Amphetamin. Wird nur von „Amphetamin“ ohne genauere Namenszusätze gesprochen, ist das 1:1-Gemisch der beiden Enantiomere gemeint (DL-Amphetamin).
Amphetamin wird in Deutschland in der Anlage III im Betäubungsmittelgesetz aufgeführt und stellt damit ein verkehrsfähiges und verschreibungsfähiges Betäubungsmittel dar; Handel und Besitz ohne Erlaubnis werden strafrechtlich verfolgt.
Überblick
Die Erstsynthese des Amphetamins gelang 1887 dem rumänischen Chemiker Lazăr Edeleanu an der Berliner Universität.[5] 1927 prägte der US-amerikanische Chemiker Gordon Alles den Namen Amphetamin, der sich aus der heute veralteten chemischen Bezeichnung alpha-Methylphenethylamin ableitet.
Ursprünglich als Bronchospasmolytikum und Appetitzügler verwendet, wird es heute aufgrund des Suchtpotenzials sowie anderer Nebenwirkungen medizinisch nur noch zur Behandlung der Narkolepsie und der Aufmerksamkeitsdefizit-/
Als Rauschmittel ist Amphetamin aufgrund seiner Wirkungen wie Unterdrückung von Müdigkeit und der Steigerung des Selbstbewusstseins vor allem in der Partyszene verbreitet. Es wird auch als Dopingmittel gebraucht. Die Menge an beschlagnahmtem Amphetamin in der Europäischen Union nimmt seit 1985 mehr oder weniger ständig zu; während ab 1999 eine gewisse Stagnation erreicht wurde, stieg die Zahl in den skandinavischen Ländern weiter an.[6][7]
Zeittafel
Vor 1900 bis 1950
- 1887 synthetisierte Lazăr Edeleanu im Zuge seiner Doktorarbeit als Erster Amphetamin.[5]
- 1893 synthetisierte der japanische Chemiker Nagayoshi Nagai das Amphetaminderivat Methamphetamin.[8]
- 1910 entdeckten die englischen Physiologen Barger und Dale, dass sich Amphetamin und das körpereigene Hormon Adrenalin in ihrer chemischen Struktur ähneln.[9]
- 1927 prägte Gordon Alles, der nach einem günstigeren und einfacher zu synthetisierenden Ersatz für das natürlich im Meerträubel vorkommende Ephedrin suchte, den Begriff Amphetamin.[9]
- 1932 brachte Smith, Kline & French Amphetaminsulfat unter dem Namen Benzedrine auf den US-amerikanischen Markt. Es wurde in Form eines Inhalators zur Weitung der Bronchien bei Atemwegserkrankungen wie Asthma genutzt. In Deutschland wurde das Mittel als Benzedrin vertrieben.
- 1935 wurde die stimulierende Wirkung erkannt und zur Behandlung von Narkolepsie genutzt.[10]
- 1937 verabreichte der Psychiater Charles Bradley in einer Studie Benzedrin an verhaltensauffällige Kinder, deren Symptome sich daraufhin besserten.[11] Er wiederholte die Studie im Jahr 1941. Bradleys Studien gelten als Meilenstein der Psychopharmakotherapie bei Kindern.[12]
- 1938 brachten die Berliner Temmler-Werke Methamphetamin unter dem Markennamen Pervitin auf den Markt, das bis 1988 hergestellt wurde.
- Bis Ende der 1930er Jahre fand Amphetamin Verbreitung und wurde in einer Vielzahl von Einsatzgebieten verschrieben: etwa als Appetithemmer, gegen Erkältungen, bei Narkolepsie, Depressionen, Schwangerschaftserbrechen und nach übermäßigem Alkoholkonsum („Kater“). Zu dieser Zeit gab es Kombipräparate (z. B. Dexamyl, eine Mischung aus Dexedrin und Amobarbital.[13]), die neben Amphetamin ein starkes Beruhigungsmittel (meistens ein Barbiturat) gegen dessen Nebenwirkungen enthielten. Solche Kombinationen werden heute als wenig sinnvoll und riskant angesehen.[14][15]
- Im Zweiten Weltkrieg wurden Amphetaminderivate in den Armeen Deutschlands (Methamphetamin, Pervitin), der Vereinigten Staaten (D,L-Amphetamin, Benzedrin), Großbritanniens und Japans eingesetzt, um bei den Soldaten die Wachsamkeit, Ausdauer und Stimmung zu heben.[15]
- 1941 wurde es in Deutschland aufgrund sich häufenden Missbrauchs und Suchtfällen dem Reichsopiumgesetz unterstellt, wodurch der Verkehr mit dem Stoff reglementiert wurde.
- 1948 brachte Glaxo-Wellcome in den USA Dexedrine (reines Dexamphetamin) als Mittel gegen ADHS auf den Markt.
1950 bis heute
- In den 1950er Jahren erreichten der Gebrauch und Missbrauch von Stimulanzien in Japan enorme Ausmaße, 1954 waren 0,7 % der Bevölkerung chronische Nutzer und 2,5 % ehemalige Konsumenten.[16] In Europa (dort vor allem in Schweden) und den USA nahm der Stimulanzienmissbrauch ebenfalls zu.
- 1959 gab es erste Berichte über Konsumenten in den USA, die sich den Inhalt der Benzedrine-Inhalatoren spritzten, daraufhin wurden zur Injektion missbrauchbare Inhalatoren vom Markt genommen. Erste Fälle von illegal produziertem Amphetamin wurden bekannt.
- 1970 wurde Amphetamin in den Vereinigten Staaten in Schedule II des Controlled Substances Act aufgenommen, somit wurden Handel, Besitz und Herstellung ohne Genehmigung strafbar; durch einen Arzt ist es weiterhin verschreibungsfähig.
- Im 1981 neugefassten Betäubungsmittelgesetz (BtMG) wurde Amphetamin in Anlage III aufgeführt, was Handel, Besitz und Herstellung ohne Genehmigung unter Strafe stellt; von Ärzten konnte es weiterhin verschrieben werden. Zuvor war Amphetamin in Deutschland ohne spezielle Auflagen verschreibbar gewesen. Heute (Stand: Dezember 2016) sind das Amphetamin-Racemat und Dexamphetamin weiterhin verkehrs- und verschreibungsfähig (siehe Rechtsstatus).
- 1996 wurde in den Vereinigten Staaten Adderall (Gemisch verschiedener Amphetaminsalze) als Mittel zur ADHS-Behandlung zugelassen.[17]
- Im Militär verschiedener Länder wird Amphetamin vermutlich bis heute zur Leistungssteigerung eingesetzt. Im Golfkrieg wurde Dexamfetamin von der Mehrheit der Kampfpiloten verwendet.[18]
Anwendungsgebiete
Amphetamin und Dexamphetamin werden in Deutschland zur Behandlung der Aufmerksamkeitsdefizit-/
Amphetamin findet in den Vereinigten Staaten (USA) wieder vermehrt Verbreitung für die medikamentöse Behandlung der ADHS, die Verschreibungszahlen stiegen in den 1990er Jahren von weniger als 1 Million Verschreibungen auf fast 6 Millionen an.[19] Laut einer Studie von 2001 im Auftrag des US-amerikanischen Kongresses gibt es in den USA keine Erkenntnisse über eine Häufung von Missbrauchsfällen unter Schülern.[20]
Amphetamin kam früher als Asthmamittel zum Einsatz, da es zum Abschwellen der Schleimhäute führt und vor allem durch die Weitung der Bronchien ein freieres Atmen ermöglicht. Es wurde außerdem als Appetitzügler und als Antidepressivum genutzt.
Wirkungen und Nebenwirkungen
Amphetamin ist ein zentrales Sympathomimetikum und wirkt im Gehirn und Rückenmark stimulierend auf den Sympathikus, einen Teil des vegetativen Nervensystems. Durch eine hinreichend hohe Dosis Amphetamin wird der Organismus in einen ergotropen Zustand versetzt, ein Stresszustand, der es ermöglicht, alle Notfallfunktionen des Organismus für eine erhöhte Handlungsbereitschaft zu aktivieren, was in lebensbedrohlichen Situationen sinnvoll ist.
Je nach Dosis und Darreichungsform können nach der Einnahme von Amphetamin folgende Wirkungen auftreten:[21][22][15]
- erhöhte Wachheit, weniger Müdigkeit, verringertes Schlafbedürfnis, Schlafstörungen und Nervosität
- erhöhte Aufmerksamkeitsspanne und Konzentrationsfähigkeit, unwillentliche Fokussierung bis hin zum Tunnelblick
- gesteigerte körperliche und geistige Ausdauer
- Verminderung bis Unterdrückung von Hunger und Durst
- erhöhte Herzfrequenz bis hin zu Herzrasen oder Kammerflimmern
- zerebraler Krampfanfall
- (Zentrales) Anticholinerges Syndrom
- Blutdruckerhöhung durch Verengung der Blutgefäße bis hin zu Bluthochdruck
- Weitung der Bronchien und Abschwellen der Schleimhäute, Mundtrockenheit
- Steigerung des Selbstbewusstseins bis hin zur Euphorie
- erhöhte Risikobereitschaft, verringerte Aggressionsschwelle
- Agitation (fahrige Bewegungsabläufe), erhöhter Bewegungsdrang, Unruhe und Symptome des Restless-Legs-Syndroms
- Tremor (Zittern), erhöhter Muskeltonus (Verspannungen), Nystagmus (Augenzittern) und Bruxismus (Zähneknirschen)
- Symptome der Hyperhidrose (erhöhte Schweißabsonderung)
- gesteigertes sexuelles Verlangen
- Weitung der Pupillen
- Harnverhalt (Unvermögen, trotz Harndrangs die Blase zu entleeren)
- Logorrhoe (gesteigertes Mitteilungsbedürfnis)
Durch chronischen Konsum können zusätzlich folgende Wirkungen eintreten:
Pharmakologie
Allgemeines
Der offizielle IUPAC-Name ist 1-Phenylpropan-2-amin. Es ist ein Homologon des Phenylethylamins. Die Amphetaminbase, eine farblose bis sehr schwach gelbliche, ölige Flüssigkeit, ist wenig löslich in Wasser, löslich in Alkoholen, Ether und schwachen Säuren wie Essigsäure. Mit alkoholisch verdünnter Schwefelsäure geht sie eine Reaktion ein und bildet das ausfallende Sulfat-Salz. Die Base hat einen charakteristischen Amingeruch. Bei höheren Konzentrationen in der Atemluft, tritt vermehrt ein Brennen der Schleimhäute auf (Augen, Nase).
Enantiomere
Amphetamin hat ein Stereozentrum am Kohlenstoffatom C2 und ist damit chiral. Daher existieren zwei Enantiomere, das Dextroisomer (Dexamphetamin, D-Amphetamin) und das Levoisomer (Levamphetamin, L-Amphetamin). Die Wirkungen beider Enantiomere sind ähnlich, Dexamphetamin weist aber ungefähr die doppelte psychoaktive Wirksamkeit von Levamphetamin auf und gilt daher als Eutomer. Als „Amphetamin“ oder D, L-Amphetamin wird das Racemat, eine 1:1-Mischung aus L-Amphetamin und D-Amphetamin, bezeichnet.[23]
Wirkungsweise
Amphetamin ähnelt in seiner chemischen Struktur sehr den Katecholaminen, kann aber weder adrenerge noch dopaminerge Rezeptoren direkt aktivieren. Es wirkt daher indirekt, indem es die Freisetzung der natürlichen Neurotransmitter Noradrenalin und Dopamin bewirkt. Es bindet auch etwa gleichermaßen gut an die Transporter von Dopamin (DA) und Noradrenalin (NA) und wirkt dort als Wiederaufnahmehemmer.[24]
Zusätzlich hemmt Amphetamin die Monoaminooxidase (MAO) und aktiviert den TAAR1 (Trace amine-associated receptor 1), einen Spurenaminrezeptor.[25]
Die Hauptwirkung des Amphetamins besteht jedoch in der Ausschüttung der Neurotransmitter Noradrenalin (NA) und Dopamin (DA). Im peripheren Nervensystem verursacht die Substanz daher eine Ausschüttung von NA. Im Gehirn jedoch scheint Amphetamin eher eine Dopamin- und weniger eine Noradrenalinausschüttung zu verursachen. Somit scheint vor allem die dopaminerge Transmission für die meisten psychostimulierenden Effekte verantwortlich zu sein.[24] Eine wesentliche Ausschüttung von Serotonin (5-HT) wird dagegen nicht beobachtet.[26]
Der Freisetzungs-Mechanismus umfasst drei Schritte:
- den Einstrom des Amphetamins in die präsynaptische Zelle über den Transporter
- die Freisetzung der Neurotransmitter aus den Vesikeln (Speicherbläschen innerhalb der Zelle) in den Zellinnenraum (Zytosol)
- den aktiven Transport der Transmitter vom Zellinneren in den außerzellulären Raum (synaptischer Spalt). Dies wird mittels einer Richtungsumkehrung des zellmembranständigen Transporters (Inversion) bewerkstelligt.[27]
Auf diese Weise wird der extrazelluläre Neurotransmitterspiegel erhöht. Im Gegensatz zum Prinzip der Wiederaufnahmehemmung geschieht dies unabhängig vom Signalimpuls der Nervenzelle.
Die wiederholte Einnahme (in rascher Folge) von Amphetamin führt zu einer kurzfristigen Toleranzentwicklung durch Tachyphylaxie. Die Speichervesikel in den Neuronen erschöpfen sich nach mehrmaliger Stimulation, sodass nach Eintritt der Tachyphylaxie kein Noradrenalin und Dopamin mehr zur Ausschüttung zur Verfügung stehen. Die Tachyphylaxie endet erst einige Stunden später, wenn sich die Speichervesikel wieder mit den Neurotransmittern aufgefüllt haben.
Verstoffwechselung
Die Plasmahalbwertszeit des Dextroamphetamins beträgt ungefähr zehn Stunden, somit dauert es knapp drei Tage, bis die Menge im Organismus auf ein Prozent der Einnahmemenge gefallen ist. Die Lipidlöslichkeit ist LogP = 1,799, es verteilt sich daher bevorzugt im Fettgewebe. Seine Proteinbindung beträgt zwischen 25 und 40 %, die Metabolisierung findet in der Leber durch das Cytochrom-P450-Isoenzym 2D6 statt.[28]
Die dabei gebildete wasserlösliche Säure wird im Urin ausgeschieden. Die Ausscheidungsmenge ist vom pH-Wert des Urins abhängig, je saurer der Urin (z. B. durch Einnahme von Ascorbinsäure oder sauren Fruchtsäften), umso schneller die Ausscheidung.[29]
Wechselwirkungen
Mit folgenden Medikamenten (unvollständige Aufzählung) sind teilweise lebensgefährliche Arzneimittelwechselwirkungen bekannt: Chlorpromazin, Fluoxetin, Fluphenazin, Fluvoxamin, Guanethidin, Isocarboxazid, Mesoridazin, Methotrimeprazin, Paroxetin, Perphenazin, Phenelzin, Prochlorperazin, Promethazin, Propericiazin, Rasagilin, Thioridazin und Trifluoperazin. Wechselwirkungen umfassen psychotische Symptome, Gefahr einer hypertensiven Krise und mögliches Auftreten eines Serotonin-Syndroms.[30] Bei gleichzeitigem Gebrauch von Monoaminooxidase-Hemmern kann der Abbau von Amphetamin gehemmt werden, was ebenso lebensgefährliche Wechselwirkungen hervorruft.[21]
Toxikologie
Die letale Dosis beim Menschen liegt bei 1,3 mg/kg (LDLo, niedrigste publizierte letale Dosis); bei 75 kg Körpergewicht entspräche das etwa 100 mg. Bei bestehender Toleranz liegt die Dosis bedeutend höher, so sind Fälle von Einzeldosen von 1000 mg und Tagesdosen von bis zu 5000 mg bekannt. Versuche mit Affen zeigten eine deutlich höhere relative Toxizität bei Jungtieren, die LD50 in mg/kg lag dort etwa 65 bis 75 % unter der von adulten Tieren.[31]
In Deutschland wurden 2010, 2013, 2014 im jeweiligen Jahr 20, 16, 21 Todesfälle gezählt, die direkt mit dem alleinigen Konsum von Amphetamin in Verbindung standen. Bei 54, 32, 35 weiteren Todesfällen in den Jahren 2010, 2013, 2014 war Methamphetamin/Amphetamin neben anderen Drogen involviert.[32][33][34]
Neurotoxizität
Es gibt keine Hinweise dafür, dass therapeutisch genutzte Amphetamindosen eine schädigende Wirkung auf Gehirnzellen haben. In Tierversuchen zeigten sich durch hohe Dosen parenteral verabreichten Amphetamins Veränderungen an dopaminergen Neuronen in Nucleus caudatus und Putamen (Teile des Striatums). Es ist unbekannt, ob die Langzeitverabreichung von hohen Amphetamindosen ähnliche Veränderungen beim Menschen hervorrufen kann. Die Langzeitverabreichung niedrigerer Dosen zeigte im Tiermodell keine derartigen Veränderungen.[35]
Herstellung und Analytik
Es existiert eine Vielzahl unterschiedlichster Syntheserouten. In der pharmazeutischen Industrie wird Amphetamin zumeist in Kondensation von 1-Phenyl-2-propanon (Phenylaceton/P2P) mit Ammoniak und anschließender Reduktion hergestellt. Dabei entsteht racemisches (RS)-Amphetamin [(RS)-1-Phenylpropan-2-amin], also ein 1:1-Gemisch aus (R)-Amphetamin [(R)-1-Phenylpropan-2-amin] und (S)-Amphetamin [(S)-1-Phenylpropan-2-amin]:
In den USA lag die von der DEA genehmigte Produktionsmenge im Jahr 2000 bei 15.000 kg, entsprechend 500.000.000 Einzeldosen zu 30 mg.[19]
Die zuverlässige qualitative und quantitative Analyse von Amphetamin gelingt in den unterschiedlichen Untersuchungsmaterialien wie Blut, Blutserum, Blutplasma,[36] Haaren,[37] Urin[38][39] oder Speichel[40] oder Abwässern[41] nach geeigneter Probenvorbereitung durch die Kopplung chromatographischer Verfahren wie der Gaschromatographie oder HPLC mit der Massenspektrometrie. Auch Enzymimmunoassays sind als Screeningtests verfügbar, sollten jedoch für forensische Zwecke durch die oben genannten spezifischeren Methoden ergänzt werden.[42]
Nichtmedizinischer Gebrauch
Beim Freizeitkonsum werden Amphetamine als Pulver, Bombe (in Papier eingewickeltes Speed) oder seltener in Pillenform konsumiert.[43] Das Pulver wird meistens durch die Nase aufgenommen, möglich sind aber auch oraler sowie parenteraler und rektaler Konsum.[44] Während die orale Aufnahme bei medizinischer Anwendung die gängige Darreichungsform ist, ist sie ansonsten wenig verbreitet. Das dürfte daran liegen, dass beim oralen Konsum die Wirkung langsamer eintritt und es aufgrund des langsameren Anflutens zu einem weniger plötzlichen Wirkungseintritt (geringerer „Kick“) kommt. Die Wirkung jedoch hält insgesamt länger an. Amphetamin hat oral eine Bioverfügbarkeit von ca. 75 %.
Anders als beim Methamphetamin ist es nicht möglich, Amphetamin zu rauchen, weil das enthaltene Amphetaminsulfat einen so hohen Siedepunkt hat, dass es sich vorher durch Pyrolyse zersetzt.
Die Europäische Beobachtungsstelle für Drogen und Drogensucht berichtet, dass 2009 der übliche Verkaufspreis von Amphetamin in der Hälfte der Berichtsländer in Europa zwischen 5 und 30 Euro pro Gramm liegt.[45] Laut Bundeskriminalamt wurden 2010 in Deutschland rund 1.200 Kilogramm Amphetamin sichergestellt, 33.482 Straftaten (1 % aller Straftaten in dem Jahr) standen im Zusammenhang mit Amphetaminderivaten.[46][47]
Amphetamin wird in Deutschland und Europa hauptsächlich in der Techno-Szene konsumiert, um unter anderem länger tanzen zu können. Es wirkt leicht euphorisierend, hält wach und ermöglicht um mehrere Stunden verlängerte Tätigkeiten. Bei nachlassender Wirkung kommt es zu Nervosität und Abgespanntheit („Abturn“); der Körper fordert die dringend benötigte Ruhe ein, aber das noch nicht abgebaute Amphetamin verhindert dies. Aus diesem Grund ist es verbreitet, sich durch den Konsum von Cannabis zu beruhigen („herunterrauchen“). Zum Teil werden starke Beruhigungsmittel aus der Stoffgruppe der Benzodiazepine wie Rohypnol oder Valium eingenommen, um zur Ruhe zu kommen.
Doping
Doping mit Amphetaminen ist seit den 1930er Jahren weit verbreitet. Da Amphetamin den Körper im Sport zusätzlich aufheizt, eignet es sich besonders bei Wettkämpfen in feucht-kaltem Wetter.[48] Seit den Olympischen Spielen 1972 wurde dem Einsatz durch Kontrollen bei Wettkämpfen weitgehend ein Riegel vorgeschoben, beispielsweise führte der Doping-Fall Jan Ullrichs, der in der Rehabilitation Amphetamine zu sich nahm, im Frühjahr 2002 zu sechs Monaten Sperre.[49] Inzwischen gestattet die WADA als internationale Anti-Doping-Agentur die Einnahme von Amphetaminen im Training und verbietet es nur noch in Wettkämpfen.[50]
Gesundheitsgefahren
Zu den gesundheitlichen Risiken, die mit dem Konsum von Amphetamin einhergehen, zählen gesteigerte Aggressivität, Krämpfe, Zittern, Kreislaufkollaps, Herzrasen und Herzinfarkt. Bei einem Abhängigkeitssyndrom können Zerfall der Muskulatur, Nierenversagen, Gedächtnisstörungen, Schlaganfall, paranoide Wahnvorstellungen und Depressionen, Bewusstseinsstörung bis hin zu Koma und chronische Psychosen auftreten.[51] Es kann zu einer Vernachlässigung sozialer Verpflichtungen (Familie, Schule, Beruf, Beziehung) kommen. Werden Amphetamine häufig geschnupft, kann es zu einer Schädigung bis zur Auflösung der Nasenscheidewand kommen.
Das Risiko, eine Abhängigkeit zu entwickeln, hängt von genetischen Faktoren und von der psychosozialen Situation der Person ab. Im Tiermodell konnten manche Individuen ihren Amphetaminkonsum lebenslang flexibel regulieren, bei 50 % trat dagegen nach einer gewissen Zeit eine Abhängigkeit mit massiver Dosissteigerung und Erwerb einer Toleranz auf, die auch nach erzwungenem Entzug bestehen blieb.[52]
Häufig geraten die Konsumenten in einen Teufelskreis aus abwechselnder Einnahme von aktivierenden und beruhigenden Drogen, wobei jedes Mittel die Nachwirkungen des anderen mildern soll.
Bei Amphetaminabhängigen kommt es nach dem Absetzen des Amphetamins zu Entzugserscheinungen. Symptome des Amphetaminentzugs sind Lethargie, Depressionen bis hin zum Suizid,[53] taktile Halluzinationen (englisch crank bugs),[54] Apathie, Angst und Schlafstörungen.[55] Möglich sind Muskelschmerzen, Bauchschmerzen und übermäßiger Appetit. Den Höhepunkt erreichen die Entzugssymptome nach etwa drei Tagen und ebben danach langsam ab.
Bei Amphetaminabhängigen finden sich hohe Raten an Begleiterkrankungen mit schizophrenen Psychosen, bipolaren Störungen, antisozialen Persönlichkeitsstörungen und ADHS. In amerikanischen Studien wurde eine Komorbidität mit Schizophrenie in bis zu 25 % der Fälle festgestellt.[56] Im Gegensatz zu einer amphetamininduzierten Psychose bestehen bei der Kombination von Amphetaminabhängigkeit und Schizophrenie psychotische Symptome noch über sechs Monate nach kontrollierter Abstinenz fort.[57] Zudem treten starke Affektschwankungen zwischen unangepasster Euphorie und schweren Depressionen durch den Konsum auf.[58][59]
Es gibt Hinweise, dass Amphetaminmissbrauch das Risiko, später an Morbus Parkinson zu erkranken, deutlich erhöht.[60]
Gestrecktes Amphetamin
Das weiß-gelbliche/rosa Pulver, das dem Drogenkonsumenten illegal als Speed angeboten wird, besteht nur zu einem Teil aus Amphetamin. Meist sind Coffein oder neutrale Streckmittel wie Glucose oder Milchzucker enthalten, aber auch andere psychoaktive Substanzen wie Paracetamol, Ephedrin oder Methamphetamin können beigemischt sein. Amphetamin wird illegal auch als „Paste“ gehandelt, die oft leicht feucht und klumpig ist und nach Amin riecht (Geruch von Fisch, der zu verwesen beginnt). Die Masse ist meist eine Mischung aus Amphetaminsalz und Lösungsmitteln.
Im Gegensatz zu den europäischen Staaten kam es in den USA häufiger vor, dass Speed mit Methamphetamin gestreckt war, was eventuell auf die bessere Verfügbarkeit der für die Synthese benötigten Ausgangsstoffe zurückzuführen war (Ephedrinpräparate waren in den USA bis März 2005 rezeptfrei erhältlich).
Da der jeweilige Amphetaminanteil unklar ist, besteht für den Konsumenten stets das Risiko einer Überdosierung sowie der Unverträglichkeit von Streckmitteln (eine tödliche Dosis kann bei einem Menschen mit 75 kg Körpergewicht schon bei etwa 100 mg Amphetamin liegen). Drugchecking hat deshalb eine wichtige Bedeutung zur Risikominderung.
Illegale Synthese
In der illegalen Produktion wird Amphetamin beispielsweise durch Reduktion von Norephedrin (Phenylpropanolamin) mit Iod und rotem Phosphor oder aus Phenylaceton gewonnen. Konnte Amphetamin früher von Privatleuten relativ ungehindert aus Vorstufen wie Phenylaceton und Hydroxylamin synthetisiert werden, wurden diese Chemikalien zunehmend von den Behörden beobachtet bzw. bei Phenylaceton und Norephedrin die ungenehmigte Herstellung und der Handel unter Strafe gestellt (Grundstoffüberwachungsgesetz). Dadurch entstand für illegal arbeitende Produzenten ein Bedarf an Ersatzstoffen, die nicht überwacht wurden. So wurde Phenylessigsäure unter anderem nach und nach in die illegale Produktion einbezogen. Seit Jahrzehnten gibt es immer neue Anweisungen für Herstellungsmöglichkeiten von Amphetamin, die Stoffe benutzen, die noch nicht verdächtig sind. Auch auf diese Herstellungswege werden die Behörden schließlich aufmerksam und der Kreislauf setzt sich fort. Sogenannte „OTC-Methoden“ (over the counter, englisch für „Über-die-[Laden-]Theke“, was etwa „frei erhältlich“ bedeutet) verbreiten sich daher zunehmend. Die Bezeichnung steht für die Gewinnung von benötigten Vorläuferstoffen aus rezeptfreien Medikamenten oder anderen frei verfügbaren Waren (Reiniger, Autozubehör), deren Abgabe anders als bei Reinstoffen nicht wirksam reglementierbar ist. So konnte beispielsweise Norephedrin (PPA) in den Vereinigten Staaten bis 2002 aus rezeptfreien Appetithemmern gewonnen werden.
Illegal wird Amphetamin hauptsächlich durch Reduktion von Phenyl-2-nitropropen mit Al(Hg) oder LiAlH4 oder durch reduktive Aminierung von Phenylaceton und Ammoniak + Al(Hg) hergestellt. Als leicht erhältliche Ausgangsstoffe dienen Benzaldehyd und Nitroethan oder die Ester der Phenylessigsäure. Die bei dieser Herstellung anfallenden Chemikalien werden zumeist illegal entsorgt: Lösemittel (Aceton, Ether, Methanol und andere) und Säuren (Schwefelsäure, Salzsäure) werden meist in Behältern nachts in freiem Gelände abgeladen oder in Flüsse entleert, teils (dazu gehören Wasserstoffkartuschen) in Brand gesteckt.[61] Unter anderem in den USA und den Niederlanden – beides Staaten mit hoher illegaler (Meth-)Amphetaminproduktion – wachsen die Umweltschäden durch giftige Nebenprodukte teilweise zu gravierenden Problemen heran. Bei der Herstellung von 1 Kilogramm Amphetamin fallen je nach Syntheseroute 5 bis 20 Liter Abfälle an. Neben der Quantität hängen die Art und die Giftigkeit der Abfälle von der jeweiligen Syntheseroute ab.[61]
Rechtsstatus
In der Bundesrepublik Deutschland ist Amphetamin im Betäubungsmittelgesetz (BtMG) aufgeführt: Das Racemat D,L-Amphetamin sowie das Dextroamphetamin sind als verkehrs- und verschreibungsfähig in Anlage III eingestuft.[62] Das reine Levoisomer Levamphetamin ist in Anlage II als verkehrs-, aber nicht als verschreibungsfähig aufgeführt.[63] Handel und Besitz ohne Rezept oder Genehmigung sind strafbar. In den USA ist Amphetamin erfasst in Schedule II des Controlled Substances Act, was den Besitz und Handel ohne Rezept oder Genehmigung unter Strafe stellt.[64] Es ist dort zugelassen für die Indikationen Narkolepsie und ADHS.[65]
Für einen Patienten dürfen Ärzte in der Bundesrepublik Deutschland innerhalb von 30 Tagen 600 mg Amphetamin oder 600 mg Dexamphetamin verschreiben. In begründeten Einzelfällen und unter Wahrung der erforderlichen Sicherheit des Betäubungsmittelverkehrs darf der Arzt für einen Patienten, der in seiner Dauerbehandlung steht, von dieser Vorschrift hinsichtlich der festgesetzten Höchstmenge abweichen. Eine solche Verschreibung ist mit dem Buchstaben „A“ zu kennzeichnen (§ 2 der Betäubungsmittel-Verschreibungsverordnung, BtMVV). Bis zur Neufassung der BtMVV vom 20. Januar 1998 (in Kraft getreten am 1. Februar 1998) durften Ärzte für einen Patienten pro Zeitspanne 10 Mal so viel wie heute verschreiben.[66]
In Österreich gelten Amphetamin, Dexamphetamin und Levamphetamin als Suchtgifte im Sinne des Suchtmittelgesetzes, da sie in der UN-Konvention über psychotrope Substanzen erfasst sind. Alle drei sind nach der Suchtgiftverordnung auf Suchtgiftrezepten verschreibungsfähig, dabei sind keine Höchstmengen festgesetzt.[67]
Seit Januar 1998 lautet in der Bundesrepublik Deutschland die behördliche Schreibweise Amfetamin, sie wurde damit der WHO-Nomenklatur angepasst.[68]
Amphetamin und Verkehrsrecht (Deutschland)
Das Führen eines Kraftfahrzeuges im Straßenverkehr wird als Ordnungswidrigkeit verfolgt (§ 24a Abs. 2,3, § 25 Abs. 2a StVG; § 4 Abs. 3 BKatV), sofern grundsätzlich der Grenzwert von 25 ng/ml im Blut überschritten wird. Gegen einen Ersttäter wird regelmäßig eine Geldbuße von 500 bis 1000 Euro und ein Fahrverbot für die Dauer von ein bis zwei Monaten (je nach vorsätzlichem oder fahrlässigem Handeln) festgelegt. Zusätzlich droht die Entziehung der Fahrerlaubnis durch die Führerscheinbehörde.
Im Falle einer aus Amphetaminkonsum resultierenden Fahruntüchtigkeit ist das Führen von Fahrzeugen oder Kraftfahrzeugen strafbar gem. § 316 StGB. Insofern droht der sofortige Entzug der Fahrerlaubnis durch die Strafverfolgungsbehörden und eine Geld- oder Freiheitsstrafe.
Handelsnamen
Fertigpräparate (Monopräparate)
In Deutschland ist seit Dezember 2011 „Attentin“ (Dexamphetaminhemisulfat) für Kinder und Jugendliche verfügbar.[69] Ein Prodrug des Dexamphetamins, das Lisdexamfetamin, ist in den USA, Deutschland, der Schweiz und anderen Ländern zur ADHS-Behandlung erhältlich.[70] In den Niederlanden lautet der Handelsname Tentin.
In den Vereinigten Staaten sind Fertigarzneimittel unter Markennamen wie „Dexedrine“, „ProCentra“ und „Zenzedi“ (Wirkstoff Dexamphetamin) zugelassen. „Adderall“ enthält eine Enantiomerenmischung aus Dexamphetamin (72,7 %) und Levamphetamin (27,3 %) und ist in sofort freisetzender und retardierter Form verfügbar.[71]
- Rezepturen
In Deutschland kann Amphetaminsulfat zusätzlich in der Apotheke als Individualrezeptur angefertigt werden. Im Neuen Rezeptur-Formularium (NRF) sind daher Einträge zu Amphetaminsulfat (Saft nach NRF 22.4 oder Kapseln nach NRF 22.5) und Dexamphetaminsulfat (2,5%ige Tropfen nach NRF 22.9) enthalten.[72] In der Schweiz können entsprechende Magistralrezepturen verschrieben oder im Ausland bestellt werden. In Österreich ist allen öffentlichen Apotheken die Abgabe entsprechender Zubereitungen gestattet.[67]
Literatur
- Walter Reginald Bett u. a.: Amphetamin in der klinischen Medizin. Springer, Berlin 1956.
- Sean Connolly: Amphetamines. Heinemann Library, Chicago 2000, ISBN 1-57572-254-2.
- Hans Cousto: Drogen-Mischkonsum. Das Wichtigste in Kürze zu den gängigsten (Party-)Drogen. Nachtschatten, Solothurn 2003, ISBN 3-03788-119-4.
- Hans-Christian Dany: Speed. Eine Gesellschaft auf Droge. Edition Nautilus, Hamburg 2008, ISBN 978-3-89401-569-5.
- A. K. Cho, David S. Segal: Amphetamine and Its Analogs. Psychopharmacology, Toxicology, and Abuse. Academic Press, San Diego 1994, ISBN 0-12-173375-0.
- Nicolas Rasmussen: On Speed. The Many Lives of Amphetamine. New York University Press, New York 2008, ISBN 978-0-8147-7601-8.
- Stephen Smith: Sucht. Die Geschichte des Stephen Smith. Ullstein, Berlin 1998, ISBN 3-548-31215-2.
- Leslie Iversen: Speed, Ecstasy, Ritalin. Amphetamine – Theorie und Praxis. Verlag Hans Huber, 2006, ISBN 3-456-84519-7.
Weblinks
- DrogenGenussKultur: Informationen zu Amphetamin und Methamphetamin
- Drugscouts: Infos zu Risiken und Wirkungen von Speed
- Shire Pharmaceuticals (Stand 2015): Beipackzettel zu Adderall Extended Release (XR)
Einzelnachweise
- ↑ a b c d e Eintrag zu Amphetamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Juni 2014.
- ↑ a b c Eintrag zu Amphetamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Eintrag zu Amphetamine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-432.
- ↑ a b Lazăr Edeleano: Über einige Derivate der Phenylmethacrylsäure und der Phenylisobuttersäure. In: Berichte der Deutschen chemischen Gesellschaft zu Berlin; 20. Jg. (1887), Band 3, S. 616–622. doi:10.1002/cber.188702001142
- ↑ EMCDDA 2001 Indikatoren für den Drogenmarkt – Sicherstellungen, Preis, Reinheit ( vom 13. Juni 2006 im Internet Archive)
- ↑ UNODC (Hrsg.): Ecstasy and Amphetamines Global Survey. 2003, ISBN 92-1148164-3 (englisch, unodc.org [PDF; abgerufen am 17. Juli 2016]).
- ↑ Nagayoshi Nagai: Kanyaku maou seibun kenkyuu seiseki (zoku). In: Yakugaku Zashi. Band 13, 1893, S. 901.
- ↑ a b D. J. Heal, S. L. Smith, J. Gosden, D. J. Nutt: Amphetamine, past and present – a pharmacological and clinical perspective. In: Journal of Psychopharmacology. Band 27, Nr. 6, 2013, S. 479–496, doi:10.1177/0269881113482532, PMID 23539642, PMC 3666194 (freier Volltext) – (englisch).
- ↑ Edward M. Brecher and the Editors of Consumer Reports Magazine, 1972: The Consumers Union Report on Licit and Illicit Drugs. Kapitel 36. The amphetamines., Consumers Union (englisch)
- ↑ C. Bradley: The Behavior of Children Recieving Benzedrine. In: American Journal of Psychiatry. 1937, Nr. 94, S. 577–581.
- ↑ Madeleine P. Strohl: Bradley's Benzedrine Studies on Children with Behavioral Disorders. In: Yale Journal of Biology and Medicine. 2011, Nr. 84, S. 27–33.
- ↑ Donald Spoto: Marilyn Monroe: The Biography. Cooper Square Press, ISBN 978-0-8154-1183-3, S. 514.
- ↑ Leslie Iversen (2008): Speed, Ecstasy, Ritalin. Amphetamine – Theorie und Praxis (Siehe Literatur).
- ↑ a b c Center for Substance Abuse Research, University of Maryland: Amphetamines ( vom 9. Februar 2006 im Internet Archive)
- ↑ 550.000/80 Mio. bzw. 2 Mio./80 Mio. M. Tamura: Japan: stimulant epidemics past and present. In: Bulletin on Narcotics. United Nations Office on Drugs and Crime, 1. Januar 1989, S. 83–93, abgerufen am 14. Juli 2006.
- ↑ Regulatory News: Richwood's Adderall. In: Health News Daily. 22. Februar 1996, abgerufen am 29. Mai 2013.
- ↑ US-Militär möchte fernsteuerbares Medikament gegen Müdigkeit entwickeln. In: Der Spiegel. 17. Juni 2024 (spiegel.de [abgerufen am 17. Juni 2024]).
- ↑ a b PBS Statistics on stimulant use (englisch).
- ↑ Attention Disorder Drugs. Few Incidents of Diversion or Abuse Identified by Schools, United States General Accounting Office 2001 (englisch, PDF; 1,9 MB).
- ↑ a b Attentin Fachinformation, Medice Arzneimittel Pütter GmbH.
- ↑ Fachinformation ( vom 18. Januar 2017 im Internet Archive) von Elvanse, Shire Pharmaceuticals
- ↑ R. C. Smith, J.M. Davis: Comparative effects of d-amphetamine, l-amphetamine and methylphenidate on mood in man. In: Psychopharmacology. Band 53, Nr. 1, 1977, S. 1–12, doi:10.1007/BF00426687, PMID 407607.
- ↑ a b Leslie L. Iversen: Speed, ecstasy, ritalin : the science of amphetamines. Oxford University Press, 2008, ISBN 978-0-19-853090-9, 2.3. How do amphetamines work?, S. 9,11–12 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David Sulzer u. a.: Mechanisms of neurotransmitter release by amphetamines: a review. In: Progress in Neurobiology. Band 75, Nr. 6, 2005, S. 406–433, doi:10.1016/j.pneurobio.2005.04.003 (pharmacology.ucsd.edu ( vom 30. Juni 2010 im Internet Archive) [PDF]).
- ↑ R. B. Rothman, M. H. Baumann: Therapeutic and adverse actions of serotonin transporter substrates. In: Pharmacology & Therapeutics. Band 95, Nummer 1, Juli 2002, S. 73–88, PMID 12163129. (Review).
- ↑ D. Sulzer, M. S. Sonders, N. W. Poulsen, A. Galli: Mechanisms of neurotransmitter release by amphetamines: a review. In: Prog. Neurobiol. Band 75, Nr. 6, April 2005, S. 406–433, doi:10.1016/j.pneurobio.2005.04.003, PMID 15955613. Volltext: bei Google Docs ( vom 30. Juni 2010 im Internet Archive)
- ↑ Eintrag zu Amphetamin in der DrugBank der University of Alberta
- ↑ Rafael de la Torre u. a.: Clinical Pharmacokinetics of amfetamine and related substances: monitoring in conventional and non-conventional matrices. In: Clinical Pharmacokinetics. Band 43, Nr. 3, März 2004, S. 177, doi:10.2165/00003088-200443030-00002, PMID 14871155.
- ↑ Eintrag zu Amphetamine in der DrugBank der University of Alberta, abgerufen am 14. November 2016.
- ↑ Poisons Information Monograph (PIM) für Amphetamine, abgerufen am 8. Dezember 2014.
- ↑ Drogenbeauftragte der Bundesregierung: Rauschgifttote nach Todesursachen 2010 – Länderabfrage ( vom 23. Dezember 2015 im Internet Archive), veröffentlicht am 24. März 2011, abgerufen am 14. Oktober 2015.
- ↑ Drogenbeauftragte der Bundesregierung: Rauschgifttote nach Todesursachen 2013 – Länderabfrage ( vom 9. Februar 2016 im Internet Archive), veröffentlicht am 17. April 2014, abgerufen am 14. Oktober 2015.
- ↑ Drogenbeauftragte der Bundesregierung: Rauschgifttote nach Todesursachen 2014 – Länderabfrage ( vom 7. April 2016 im Internet Archive), veröffentlicht 2015, abgerufen am 28. April 2016.
- ↑ S. Berman u. a.: Abuse of amphetamines and structural abnormalities in the brain. In: Ann N Y Acad Sci. Band 1141, 2008, S. 195–220, doi:10.1196/annals.1441.031, PMID 18991959, PMC 2769923 (freier Volltext).
- ↑ C. Kde Mariotti, R. S. Schuh, P. Ferranti, R. S. Ortiz, D. Z. Souza, F. Pechansky, P. E. Froehlich, R. P. Limberger: Simultaneous analysis of amphetamine-type stimulants in plasma by solid-phase microextraction and gas chromatography-mass spectrometry. In: J Anal Toxicol. 38(7), 2014 Sep, S. 432–437. PMID 25038769
- ↑ S. Pichini, O. García-Algar, A. T. Alvarez, M. Mercadal, C. Mortali, M. Gottardi, F. Svaizer, R. Pacifici: Pediatric exposure to drugs of abuse by hair testing: monitoring 15 years of evolution in Spain. In: Int J Environ Res Public Health. 11(8), 2014 Aug 14, S. 8267–8275. PMID 25153461
- ↑ M. L. Smith, D. C. Nichols, P. Underwood, Z. Fuller, M. A. Moser, R. Flegel, D. A. Gorelick, M. N. Newmeyer, M. Concheiro, M. A. Huestis: Methamphetamine and amphetamine isomer concentrations in human urine following controlled vicks vapoinhaler administration. In: J Anal Toxicol. 38(8), 2014 Oct, S. 524–527. PMID 25217541
- ↑ H. R. Lin, C. C. Liao, T. C. Lin: Improved identification of multiple drugs of abuse and relative metabolites in urine samples using liquid chromatography/triple quadrupole mass spectrometry coupled with a library search. In: Rapid Commun Mass Spectrom. 28(19), 2014 Oct 15, S. 2043–2053. PMID 25156593
- ↑ S. Macdonald, C. J. Cherpitel, T. Stockwell, G. Martin, S. Ishiguro, K. Vallance, J. Brubacher: Concordance of self-reported drug use and saliva drug tests in a sample of emergency department patients. In: J Subst Use. 19(1–2), 2014 Mar 1, S. 147–151. PMID 25104914
- ↑ T. Mackuľak, J. Skubák, R. Grabic, J. Ryba, L. Birošová, G. Fedorova, V. Spalková, I. Bodík: National study of illicit drug use in Slovakia based on wastewater analysis. In: Sci Total Environ. 2014 Oct 1; 494–495, S. 158–165. PMID 25046607
- ↑ M. Sundström, A. Pelander, I. Ojanperä: Comparison between drug screening by immunoassay and ultra-high performance liquid chromatography/high-resolution time-of-flight mass spectrometry in post-mortem urine. In: Drug Test Anal. 2014 Jun 20. PMID 24953563
- ↑ Nicolas Rasmussen: On Speed: The Many Lives of Amphetamine. NYU Press, 2008, ISBN 978-0-8147-7627-8.
- ↑ Drogen-Razzia: Größte Amphetamin-Menge seit 15 Jahren beschlagnahmt. In: Berliner Morgenpost. 8. Juni 2012. Abgerufen am 22. November 2013.
- ↑ Europäische Beobachtungsstelle für Drogen und Drogensucht: Drogenproblematik in Europa 2009 (PDF; 3,8 MB).
- ↑ Jahreskurzlage Rauschgift 2010 ( vom 11. Januar 2012 im Internet Archive), Daten zur Rauschgiftkriminalität des BKA.
- ↑ Daten zur Kriminalität in Deutschland 2010.
- ↑ Arnd Krüger: Die Einordnung der Leistung Roger Bannisters in die Geschichte des Trainings für Mittel- und Langstrecke. In: J. Buschmann, S. Wassong (Hrsg.): Langlauf durch die olympische Geschichte. Festschrift für Karl Lennartz. Carl und Liselott Diem – Archiv, Köln 2005, ISBN 3-88338-015-6, S. 349–372.
- ↑ Ullrich gesteht Einnahme von Amphetamin. ( vom 1. Juli 2015 im Internet Archive) auf: berlinonline.de, 8. Juli 2002, abgerufen am 8. August 2008.
- ↑ NADA (Hrsg.): The 2014 Prohibited List International Standard. Prohibited List 2014 (PDF; 106 kB).
- ↑ Drugcom: Häufig gestellte Fragen: Welche akuten Risiken sind mit Speedkonsum verbunden? In: www.drugcom.de.
- ↑ Gabriel Galli, Jochen Wolffgramm: Long-term voluntary D-amphetamine consumption and behavioral predictors for subsequent D-amphetamine addiction in rats. In: Drug and Alcohol Dependence. Band 73, Nr. 1, 2004, S. 51–60, doi:10.1016/j.drugalcdep.2003.09.003.
- ↑ E. Gouzoulis-Mayfrank: Kap. 3.3: Störungen durch Stimulanzien des Amphetamintyps. In: Ulrich Voderholzer, Fritz Hohagen (Hrsg.): Therapie psychischer Erkrankungen. Elsevier Health Sciences, 2020, ISBN 978-3-437-09718-8, S. 69 (google.de [abgerufen am 9. August 2021]).
- ↑ Jan Dirk Blom: A Dictionary of Hallucinations. Springer 2009, ISBN 978-1-4419-1223-7, S. 122.
- ↑ A. Testa, R. Giannuzzi, F. Sollazzo, L. Petrongolo, L. Bernardini, S. Dain: Psychiatric emergencies (part II): psychiatric disorders coexisting with organic diseases. In: European Review for Medical and Pharmacological Sciences. Band 17, Suppl 1, Februar 2013, S. 65–85, PMID 23436669. PDF.
- ↑ Gouzoulis-Mayfrank E.: "Komorbidität Psychose und Sucht. Von den Grundlagen zur Praxis." Steinkopff, Darmstadt, 2003
- ↑ R. Thomasius, E. Gouzoulis-Mayfrank u. a.: AWMF-Behandlungsleitlinie: Psychische und Verhaltensstörungen durch Kokain, Amphetamine, Ecstasy und Halluzinogene. In: Fortschritte der Neurologie - Psychiatrie. 72, 2004, S. 679, doi:10.1055/s-2004-818531.
- ↑ S2-Leitlinie: Psychische und Verhaltensstörungen durch Kokain, Amphetamine, Ecstasy und Halluzinogene, AWMF-Registernummer 076/007 (online: Volltext ( vom 2. Januar 2005 im Internet Archive)), Stand 10/2004.
- ↑ J. G. Bramness u. a.: Amphetamine-induced psychosis–a separate diagnostic entity or primary psychosis triggered in the vulnerable? In: BMC psychiatry. Band 12, 2012, S. 221, doi:10.1186/1471-244X-12-221. PMID 23216941. PMC 3554477 (freier Volltext).
- ↑ Using Amphetamines May Increase Risk of Parkinson’s Disease ( vom 22. Oktober 2012 im Internet Archive), American Academy of Neurology vom 20. Februar 2011, abgerufen am 22. Februar 2011.
- ↑ a b The „Dirty“ and Dangerous Side Effects of Synthetic Drugs Production. ( vom 3. Februar 2006 im Internet Archive) Europol (englisch).
- ↑ Anlage III BtMG - Einzelnorm. In: www.gesetze-im-internet.de.
- ↑ Anlage II zu § 1 Abs. 1 BtMG.
- ↑ Schedule II Section d des CSA ( vom 9. August 2017 im Internet Archive) (englisch).
- ↑ Federal Drug Administration (FDA): Adderall (Stand Oktober 2015)
- ↑ 200 mg/Tag = 6000mg/30 Tage = 10 x (600 mg/30 Tage)
4. BtMÄndV Art. 4 vom 23. Dezember 1992 (BGBl. 1992 I S. 2483; 2487). - ↑ a b Rechtsinformationssystem des Bundeskanzleramts Österreich, Bundesrecht konsolidiert: Gesamte Rechtsvorschrift für Suchtgiftverordnung, Fassung vom 30. März 2014.
- ↑ 10. BtMÄndV Art. 1 Nr. 1 Buchst. b; Art. 1 Nr. 3; Art. 3 (BGBl. I, S. 74).
- ↑ Dexamfetamin, Attentin® (Medice Arzneimittel). In: Pharmazeutische Zeitung online. Abgerufen am 5. August 2013.
- ↑ Lisdexamfetamin, Elvanse® (Shire). ( vom 26. April 2014 im Internet Archive) In: Pharmazeutische Zeitung online. Abgerufen am 5. August 2013.
- ↑ Elaine Moore: The Amphetamine Debate: The Use of Adderall, Ritalin and Related Drugs for Behavior Modification, Neuroenhancement and Anti-Aging Purposes. McFarland, 2010, ISBN 978-0-7864-8012-8 (eingeschränkte Vorschau in der Google-Buchsuche), S. 90, Corrigendum: Dexamphetamine statt Lisdexamphetamine.
- ↑ Govi-Verlag: Standardisierte Rezepturen. Govi-Verlag, 2017, ISBN 978-3-7741-1350-3, S. 92 (Kapseln und Saft), S. 93 (Tropfen) (eingeschränkte Vorschau in der Google-Buchsuche).