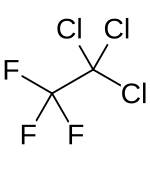
1,1,1-Trichlor-2,2,2-trifluorethan
1,1,1-Trichlor-2,2,2-trifluorethan ist eine chemische Verbindung des Chlors aus der Gruppe der Fluorchlorkohlenwasserstoffe.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,1,1-Trichlor-2,2,2-trifluorethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Cl3CCF3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 187,38 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,579 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
46 °C[1] | ||||||||||||||||||
| Dampfdruck |
399,78 hPa (20 °C)[1] | ||||||||||||||||||
| Löslichkeit |
löslich in Ethanol, Ether und Chloroform[2] | ||||||||||||||||||
| Brechungsindex |
1,3599 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Treibhauspotential |
6000[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Bearbeiten1,1,1-Trichlor-2,2,2-trifluorethan kann durch Umwandlung von 1,1,2-Trichlor-1,2,2-trifluorethan im Temperaturbereich von 593-713 K unter Strömungsbedingungen und unter Verwendung der Katalysatoren β-AlF3 oder Aluminiumoxid gewonnen werden.[4]
Eigenschaften
Bearbeiten1,1,1-Trichlor-2,2,2-trifluorethan ist eine farblose Flüssigkeit.[1] Die kritische Temperatur liegt bei 209,8 °C[5] und sie hat ein Ozonabbaupotential von 0,8.[3]
Verwendung
Bearbeiten1,1,1-Trichlor-2,2,2-trifluorethan wird zur Herstellung von anderen Chemikalien (wie zum Beispiel Pyrethroiden[6]) verwendet.[7]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j Datenblatt 1,1,1-Trichlorotrifluoroethane, 99% bei Sigma-Aldrich, abgerufen am 1. Januar 2018 (PDF).
- ↑ Richard Montgomery Stephenson: Handbook of the Thermodynamics of Organic Compounds. Springer Science & Business Media, 2012, ISBN 978-94-009-3173-2, S. 24 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Charles V. Rades, Evan B. Tilesman: Advances in Environmental Research. Nova Publishers, 2008, ISBN 978-1-60456-413-6, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Bozorgzadeh, E. Kemnitz, M. Nickkho-Amiry, T. Skapin, J.M Winfield: Conversion of 1,1,2-trichlorotrifluoroethane to 1,1,1-trichlorotrifluoroethane and 1,1-dichlorotetrafluoroethane over aluminium-based catalysts. In: Journal of Fluorine Chemistry. 107, 2001, S. 45, doi:10.1016/S0022-1139(00)00350-X.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 176 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard D. Chambers: Organofluorine Chemistry Techniques and Synthons. Springer, 2003, ISBN 978-3-540-69197-6, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ halocarbon.com: 1,1,1-Trichloro-2,2,2-trifluoroethane (113a) ( vom 26. Mai 2010 im Internet Archive), abgerufen am 1. Januar 2018