Alkylsulfatase
Alkylsulfatase (SdsA1) ist ein in Pseudomonas aeruginosa, einem Stäbchenbakterium, vorkommendes Protein, welches zur Gruppe der Sulfatester-spaltenden Enzyme (Sulfatasen) gehört.
| Alkylsulfatase 1 | ||
|---|---|---|
| ||
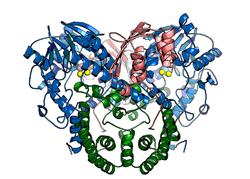
| Darstellung des nativen Proteins SdsA1, blau: N-terminale Domäne, grün: Dimerisierungsdomäne, rötlich: C-terminale Domäne, gelb: Zinkionen[1] | ||
| Masse/Länge Primärstruktur | 528 Aminosäuren; 58,9 kDa | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | 2 Zn2+ | |
| Bezeichner | ||
| Gen-Name(n) | sdsA ; sdsA1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.6.-, Esterase | |
| Reaktionsart | Hydrolyse | |
| Substrat | Sulfatester, Dodecylsulfat | |
| Vorkommen | ||
| Homologie-Familie | Alkylsulfatase | |
| Übergeordnetes Taxon | Pseudomonas | |
Die Bezeichnung SdsA1 geht darauf zurück, dass das Enzym neben einer Vielzahl von aliphatischen Sulfatestern ebenfalls das stark denaturierende Tensid Natriumdodecylsulfat (engl. SDS) abbauen kann. Homologe von SdsA1 werden in vielen pathogenen und einigen nicht-pathogenen Bakterien gefunden. Das Protein gehört zur dritten Klasse von Sulfatasen, die es Pseudomonas Aeruginosa erlaubt, unter bakteriziden Bedingungen überleben zu können. Maßgebliche Aufklärungsarbeit zu Struktur und Reaktionsmechanismus wurde durch Hagelüken et al. betrieben.[1]
Aufbau
BearbeitenDas Protein kommt nativ als symmetrisches Homodimer vor, es kristallisiert in der Raumgruppe P6522 (Raumgruppen-Nr. 179). Jedes Monomer besteht aus drei Proteindomänen: der N-terminalen, katalytisch-aktiven Domäne, welche als integralen Bestandteil einen 2-kernigen Zinkcluster besitzt und zur Familie der Metallo-β-Lactamase Proteinfaltung gehört; einer Dimerisierungsdomäne, die für die Stabilität gegenüber dem bakteriziden SDS verantwortlich ist und einer C-terminalen hydrophoben Domäne.
Reaktionsmechanismus
BearbeitenDie beiden katalytisch aktiven Zinkionen werden durch ein gemeinsames Hydroxidion verbrückt, wobei dieses im Gegensatz zu Phosphatasen höchstwahrscheinlich nicht als Nukleophil fungiert. Als Beweis führen Hagelüken et al. vor allem die ungewöhnlich hohen Abstände zwischen dem direkt gebundenen Hydroxidion und der zu spaltenden Sulfatgruppe an. Als alternatives Nukleophil kann ein zweites Wassermolekül angenommen werden, welches genau zwischen dem direkt gebundenen Hydroxidion und dem Sulfat-Schwefelatom liegt. Dieses wird zusätzlich durch die negativ geladene Aminosäure Glutamat an der Position 299 koordiniert und polarisiert. Dadurch ist die Nukleophilie des zweiten Wassermoleküls groß genug, um den elektrophilen Schwefel anzugreifen. Nach einem trigonal-bipyramidalen Übergangszustand wird der abgehende Alkohol durch die Aminosäure Arginin an der Position 312 protoniert. Damit ist die Spaltung des Sulfatesters zu Sulfat und dem entsprechenden Alkohol beendet und die Katalyse kann von vorn beginnen.
Einzelnachweise
Bearbeiten- ↑ a b Hagelüken et al. (2006): The crystal structure of SdsA1, an alkylsulfatase from Pseudomonas aeruginosa, defines a third class of sulfatases. In: Proc. Natl. Acad. Sci. U.S.A. 103(20):7631-7636. PMID 16684886