Allolactose
Allolactose ist ein Disaccharid, das im Bakterium Escherichia coli aus Lactose durch das Enzym β-Galactosidase gebildet wird. Dieser Zucker ist der natürliche Induktor des Lac-Repressors, der durch Bindung inaktiviert wird und dadurch die Transkription der Strukturgene des lac-Operons induziert.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Allolactose | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H22O11 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 342,3 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
168 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||

Synthese der Allolactose
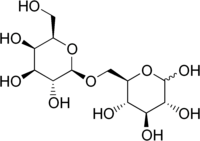
BearbeitenAllolactose ist ein lactoseartiges Disaccharid, das aus den Monosacchariden D-Galactose und D-Glucose besteht, die über eine β-1,6-glycosidische Bindung miteinander verknüpft sind. Nach IUPAC wird die Allolactose als β-D-Galactopyranosyl-(1→6)-D-Glucopyranose bezeichnet. 1972 wurde Allolactose erstmal als Induktor für das lac-Operon beschrieben.[2] Es handelt sich um ein Lactose-Isomer, das durch einen intramolekularen Galactose-Transfer auf D-Glucose gebildet wird. Katalysiert wird diese Reaktion durch die bakterielle β-Galactosidase. Die β-Galactosidase kann aufgrund ihrer bifunktionellen Aktivität sowohl die Hydrolyse der Lactose und Allolactose in D-Galactose und D-Glucose als auch die Isomerisierung der Lactose in die Allolactose katalysieren. Bei dieser Umlagerungsreaktion wird die β-glykosidische Bindung der Lactose-4-O-(β-D-Galactopyranosyl)-D-glucopyranose nach IUPAC zu einer 1→6-Bindung in der Allolactose umgelagert.[3] Die Synthesegeschwindigkeit der Allolactose entspricht ungefähr 8 % bis 10 % der Geschwindigkeit der Hydrolyse der Lactose.[4]
Biologische Bedeutung der Allolactose für das lac-Operon
BearbeitenDie Strukturgene für den Import und die Verwertung der Lactose werden in Escherichia coli durch ein Repressorprotein, negativ reguliert. Der lac-Repressor bindet an den cis-aktivierten Operator und inhibiert dadurch die Transkription der Strukturgene. Allolactose, der Induktor des lac-Operons, bindet wiederum an den lac-Repressor. Die dadurch ausgelöste Konformationsänderung vermindert die Bindungsaffinität des Repressors an den lac-Operator. Durch diese Blockierung des Repressors kann die Transkription der Strukturgene des lac-Operons lacZ (β-Galactosidase), lacY (β-Galactosid-Permease) und lacA (β-Galactosid-Transacetylase) erfolgen. Die RNA-Polymerase bindet an die Promotorsequenz und leitet dadurch die Transkription der Strukturgene des lac-Operons ein. Der Induktor wird im Anschluss durch die β-Galactosidase in die Zucker D-Glucose und D-Galactose hydrolysiert. Infolgedessen blockiert der aktive Repressor das lac-Operon und hemmt damit die Synthese der Polypeptide.[5] Im Vergleich zur Allolactose wird der künstliche Induktor Isopropyl-β-D-thiogalactopyranosid, der in der Molekularbiologie Verwendung findet, deutlich langsamer abgebaut.
Einzelnachweise
Bearbeiten- ↑ a b c d Eintrag zu Allolactose bei TCI Europe, abgerufen am 10. April 2021.
- ↑ A. Jobe, S. Bourgeois: lac Repressor-operator interaction. VI. The natural inducer of the lac operon. In: Journal of Molecular Biology. Band 69, Ausgabe 3, 1972, S. 397–408, doi:10.1016/0022-2836(72)90253-7.
- ↑ Robert W. Wheatley, Summie Lo, Larisa J. Jancewicz, Megan L. Dugdale, Reuben E. Huber: Structural Explanation for Allolactose (lac Operon Inducer) Synthesis by lacZ β-Galactosidase and the Evolutionary Relationship between Allolactose Synthesis and the lac Repressor. In: Journal of Biological Chemistry., Band 288, Ausgabe 18, S. 12993–3005, 2013, doi:10.1074/jbc.M113.455436 (freier Volltext).
- ↑ Alan Jobe, Suzanne Bourgeois: lac repressor-operator interaction: VI. The natural inducer of the lac operon. In: Journal of Molecular Biology. Band 69, Ausgabe 3, 28. August 1972, S. 397–404, doi:10.1016/0022-2836(72)90253-7.
- ↑ Mitchell Lewis: The lac repressor. In: Comptes Rendus Biologies. Band 328, Ausgabe 6, Juni 2005, S. 521–548, doi:10.1016/j.crvi.2005.04.004.