Ammoniumsulfit
Ammoniumsulfit ist eine anorganische chemische Verbindung aus der Gruppe der Sulfite.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
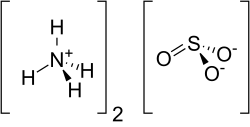
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumsulfit | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | (NH4)2SO3 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 116,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
1,41 g·cm−3 (Monohydrat)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenAmmoniumsulfit entsteht bei der Rauchgasentschwefelung, bei der Schwefeldioxid nach Zugabe von Ammoniak aus den abgekühlten Rauchgasen ausgewaschen wird.[4]
Dabei reagieren Schwefeldioxid und Ammoniakdampf in Gegenwart von überschüssigem Wasserdampf oder von Wassertröpfchen nach den Gleichungen:[5]
- (1)
- (2)
Wenn nicht genügend Wasser vorhanden ist, bildet sich eine orange-gelbe Verbindung, wahrscheinlich ein Amidosulfit. Ist ein Überschuss an Schwefeldioxid vorhanden, so bildet sich reines Ammoniumsulfit.[5] Ammoniumsulfit entsteht auch bei der Zersetzung von Ammoniumthiosulfat.
Eigenschaften
BearbeitenAmmoniumsulfit ist ein brennbarer, weißer, geruchloser Feststoff, der leicht in Wasser löslich ist. Er zersetzt sich bei Erhitzung über 60–70 °C.[2] Das Monohydrat hat eine Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[6]
Verwendung
BearbeitenAmmoniumsulfit wird zur Herstellung des dunklen Lebensmittelfarbstoffs Ammoniumsulfit-Zuckerkulör (E150d) verwendet.[7]
Zu den Produkten, die damit gefärbt werden, zählen Instantsuppen, Fertigsaucen, Süßwaren und Limonaden.[8]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Eintrag zu AMMONIUM SULFITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- ↑ a b c d e f g Eintrag zu Ammoniumsulfit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Juli 2014. (JavaScript erforderlich)
- ↑ Eintrag zu Ammonium Sulfite in der Hazardous Substances Data Bank (via PubChem), abgerufen am 29. Juli 2014.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 656.
- ↑ a b Simon J. Rothenberg, Alan R. Dahl, Edward B. Barr, Ronald K. Wolff: Generation, Behavior, and Toxicity of Ammonium Sulfite Aerosols. 1986, doi:10.1080/00022470.1986.10466045.
- ↑ L. F. Battelle, K. N. Trueblood: The crystal structure of ammonium sulfite monohydrate. In: Acta Crystallographica. Band 19, Nr. 4, 1965, S. 531–535, doi:10.1107/S0365110X65003845.
- ↑ Werner Baltes, Reinhard Matissek: Lebensmittelchemie. Springer-Verlag, 2011, S. 258 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lexikon der Zusatzstoffe. Farbstoffe. E 150 d Ammonsulfit-Zuckerkulör Deutsches Zusatzstoffmuseum, abgerufen am 15. März 2024
