Anissäure
Anissäure ist eine methoxylierte Benzoesäure, also eine Methoxybenzoesäure und somit sowohl eine Carbonsäure als auch ein Ether.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
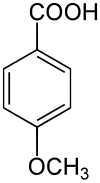
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Anissäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H8O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristallnadeln[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 152,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,39 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
277 °C[2] | |||||||||||||||||||||
| pKS-Wert |
4,47[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,571–1,576[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
In der deutschsprachigen Literatur wird der Trivialname Anissäure hauptsächlich für die 4-Methoxybenzoesäure verwendet, während in der englischsprachigen Literatur der Begriff Anissäure (anisic acid) für alle drei Isomere der Methoxybenzoesäuren verwendet wird. Man unterscheidet dort zwischen o-anisic acid (2-Methoxybenzoesäure), m-anisic acid (3-Methoxybenzoesäure) und p-anisic acid (4-Methoxybenzoesäure).
Vorkommen
BearbeitenAnissäure kommt in geringen Mengen im Öl von Anis und anderen Pflanzen (z. B. Vanille) vor.[7]
Gewinnung und Darstellung
BearbeitenAnissäure ist sehr einfach zugänglich durch Grignard-Reaktion von p-Bromanisol mit Kohlendioxid. Anissäure kann auch durch Oxidation von 4-Methoxyacetophenon mit Hypobromit gewonnen werden (Einhorn-Reaktion).[8][9]
Eine weitere sehr einfache Synthese von Anissäure ist die Oxidation von Anisaldehyd mit einem Oxidationsmittel wie Kaliumpermanganat.
Verwendung
BearbeitenAnissäure wird zur Herstellung von Anissäure-Derivaten wie z. B. Dronedaron[10] verwendet. Sie wirkt bakteriostatisch und wurde früher als Antiseptikum, Antirheumatikum und Konservierungsmittel verwendet.
Sicherheitshinweise
BearbeitenDie Dämpfe von Anissäure können mit Luft erst bei sehr hohen Temperaturen ein explosionsfähiges Gemisch bilden. Der Flammpunkt liegt bei 185 °C, die Zündtemperatur bei 185 °C und die Zersetzungstemperatur bei >400 °C.[2]
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ Eintrag zu P-ANISIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c d e f g Eintrag zu 4-Methoxybenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu Anissäure bei ChemBlink, abgerufen am 22. Dezember 2019.
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-330.
- ↑ Datenblatt Anissäure (PDF) bei Carl Roth, abgerufen am 14. Februar 2010.
- ↑ Liber Herbarum Minor: Anissäure.
- ↑ Versuch zur Herstellung von Anissäure. ( vom 17. Juni 2009 im Internet Archive) (PDF; 32 kB)
- ↑ Patent EP0213340: Verfahrung zur Herstellung von Carbonsäuren. Angemeldet am 11. Juli 1986, veröffentlicht am 2. Mai 1991, Anmelder: Dynamit Nobel AG, Erfinder: Marcel Feld.
- ↑ Patent CN101993427: New method for preparing Dronedarone. Angemeldet am 26. August 2009, veröffentlicht am 10. Oktober 2012.