Delamanid
Delamanid (Handelsname Deltyba, Hersteller Otsuka Pharmaceutical) ist ein Arzneistoff aus der Gruppe der Dihydro-Nitroimidazooxazole, der in der Behandlung von multiresistenter Tuberkulose eingesetzt wird.[2]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
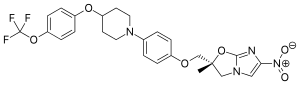
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Delamanid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C25H25F3N4O6 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 534,49 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Anwendungsgebiet
BearbeitenAm 28. April 2014 erteilte die Europäische Kommission Delamanid als Deltyba eine Zulassung zur Behandlung der multiresistenten Tuberkulose in der gesamten Europäischen Union.[3] In der EU hat Deltyba den Status eines Orphan-Arzneimittels.[4] Es wird eingesetzt, wenn die Standardmedikamente Isoniazid (INH), Rifampicin (RMP), Ethambutol (EMB), Pyrazinamid (PZA) und Streptomycin (SM) versagen.[5]
Erstmals beschrieben wurde der Wirkstoff 2003 unter dem Entwicklungscode OPC-67683.[6]
Wirkungsmechanismus
BearbeitenDelamanid stört den Zellwandaufbau über eine Hemmung der Biosynthese von Mykolsäuren (IC50 = 0,036 μg/mL bzw. 0,021 μg/mL).[2]
Wechselwirkungen
BearbeitenDelamanid interagiert mit starken Induktoren des Leberenzyms Cytochrom P450 3A4, zum Beispiel Carbamazepin, sowie mit anderen Arzneimitteln, die die QT-Zeit verlängern.[7]
Aufnahme und Verteilung im Körper
BearbeitenNach oraler Aufnahme wird nach 4–5 h die maximale Konzentration erreicht. Die Halbwertszeit nach Ende der Einnahme liegt bei 38 h. Nach 10–14 Tagen wird das Steady state (Gleichgewichtskonzentration) erreicht.[8]
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ a b c Datenblatt Delamanid bei Sigma-Aldrich, abgerufen am 23. Januar 2024 (PDF).
- ↑ a b Eintrag zu Delamanid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Mai 2015.
- ↑ Zusammenfassung des EPAR für die Öffentlichkeit. EMA, April 2014, abgerufen am 4. April 2017., EU/1/13/875, abgerufen am 11. Mai 2020.
- ↑ Union Register of medicinal products for human use – Deltyba, EU/1/13/875, abgerufen am 12. Mai 2020.
- ↑ Medscape Deutschland: Multiresistente Tuberkulose: Bald zwei neue Wirkstoffe in der EU zugelassen?, 16. Januar 2014.
- ↑ Makoto Matsumoto, Hiroyuki Hashizume, Tatsuo Tomishige, Masanori Kawasaki, Hidetsugu Tsubouchi, Hirofumi Sasaki, Yoshihiko Shimokawa, Makoto Komatsu: OPC-67683, a Nitro-Dihydro-Imidazooxazole Derivative with Promising Action against Tuberculosis In Vitro and In Mice. In: PLoS Medicine. Band 3, Nr. 11, 2006, S. e466, doi:10.1371/journal.pmed.0030466 (englisch).
- ↑ D. Biermann: EU-Zulassung von Delamanid gegen multiresistente Tuberkulose, Pharmazeutische Zeitung, 14. Mai 2014.
- ↑ A. S. Xavier, M. Lakshmanan: Delamanid: A new armor in combating drug-resistant tuberculosis. In: Journal of Pharmacology & Pharmacotherapeutics. Band 5, Nummer 3, Juli 2014, S. 222–224, doi:10.4103/0976-500X.136121, PMID 25210407, PMC 4156838 (freier Volltext).