Difluordisulfan
Difluordisulfan ist eine chemische Verbindung zwischen Fluor und Schwefel und isomer zu Thiothionylfluorid.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
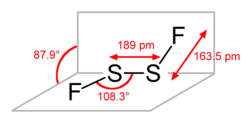
| ||||||||||
| Allgemeines | ||||||||||
| Name | Difluordisulfan | |||||||||
| Summenformel | F2S2 | |||||||||
| Kurzbeschreibung |
farbloses Gas mit unangenehmem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 102,12 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig[2] | |||||||||
| Dichte |
4,3 kg·m−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
−15 °C[3] | |||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Gewinnung und Darstellung
BearbeitenDifluordisulfan kann durch Reaktion von Silber(I)-fluorid mit Schwefel bei 125 °C gewonnen werden.[5]
Eigenschaften
BearbeitenDifluordisulfan ist ein farbloses Gas mit unangenehmem Geruch.[1][2] Es wandelt sich bei höheren Temperaturen und Drücken in das stabilere Thiothionylfluorid und dann weiter in Schwefeltetrafluorid und Schwefel um. Selbst bei Raumtemperatur wandelt sich die Verbindung bei Anwesenheit von Fluorwasserstoff oder Natriumfluorid in Thiothionylfluorid um. Mit Stickstoffdioxid reagiert Difluordisulfan im Gegensatz zu Thiothionylfluorid zu Nitrosylfluorosulfat.[3]
Einzelnachweise
Bearbeiten- ↑ a b c d Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 704 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Hans Peter Latscha, Helmut Alfons Klein: Anorganische Chemie. Springer DE, 2002, ISBN 3-540-42938-7, S. 341 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 379.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 182.