Quecksilber(II)-benzoat
chemische Verbindung
Quecksilber(II)-benzoat ist eine chemische Verbindung des Quecksilbers aus der Gruppe der Carbonsäuresalze.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
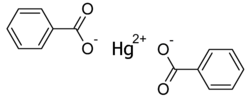
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Quecksilber(II)-benzoat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H10HgO4 | |||||||||||||||
| Kurzbeschreibung |
schwer entzündbarer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 442,82 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenQuecksilber(II)-benzoat kann durch die Zugabe von Kaliumbromid zu einer Lösung aus einem Quecksilbersalz und Benzoesäure gewonnen werden.[4]
Eigenschaften
BearbeitenQuecksilber(II)-benzoat ist ein brennbarer, schwer entzündbarer Feststoff, der löslich in Wasser ist.[1] Das weiße geruchlose[5] Monohydrat ist wenig löslich in Ethanol.[2] Es hydrolysiert in kochendem Wasser.[5]
Verwendung
BearbeitenQuecksilber(II)-benzoat wurde früher als Arzneimittel in der Behandlung der Syphilis verwendet.[6]
Einzelnachweise
Bearbeiten- ↑ a b c d e Eintrag zu Quecksilber(II)-benzoat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Juni 2016. (JavaScript erforderlich)
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2016, ISBN 978-1-4665-7115-0, S. 75 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt Mercury(II) benzoate hydrate, 99% bei Sigma-Aldrich, abgerufen am 28. Juni 2016 (PDF).
- ↑ Eintrag zu Mercuric benzoate in der Hazardous Substances Data Bank (via PubChem), abgerufen am 28. Juni 2016.
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 257 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ S. Gangolli: The Dictionary of Substances and Their Effects: K-N. Royal Society of Chemistry, 1999, ISBN 978-0-85404-828-1, S. 224 (eingeschränkte Vorschau in der Google-Buchsuche).


