Rimegepant
Rimegepant ist ein Arzneistoff aus der Wirkstoffklasse der niedermolekularen CGRP-Rezeptorantagonisten (Gepante). Er wird zur Behandlung akuter Migräneattacken sowie auch zur Vorbeugung (Prophylaxe) bei episodischer Migräne angewendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
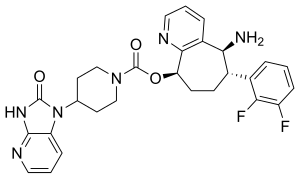
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Rimegepant[1] | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C28H28F2N6O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus |
CGRP-Rezeptor-Hemmung | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 534,56 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Rimegepant ist peroral wirksam.
Eigenschaften
BearbeitenRimegepant wird pharmazeutisch in Form des Schwefelsäuresalzes Rimegepanthemisulfat-Sesquihydrat[3] eingesetzt. Das Salz ist ein weißer bis fast weißer kristalliner Feststoff, der in Wasser schwer löslich ist.[4]
Wirkungsmechanismus
BearbeitenGepante sind niedermolekulare CGRP-Rezeptor-Antagonisten. CGRP steht für Calcitonin Gene-Related Peptide, ein Neuropeptid, das an der Auslösung von Migräneanfällen beteiligt ist.
Rimegepant blockiert den CGRP-Rezeptor und hebt dadurch die Effekte von CGRP auf. Anders als die CGRP-Inhibitoren aus der Gruppe der monoklonalen Antikörper kann das niedermolekulare Rimegepant oral gegeben werden.
Medizinische Verwendung
BearbeitenDie zugelassenen Anwendungsgebiete umfassen die akute Behandlung von Migräne mit oder ohne Aura bei Erwachsenen sowie die vorbeugende Behandlung der episodischen Migräne bei Erwachsenen,[4] die mindestens 4 Migräneanfälle pro Monat haben.[5] In der EU ist es das erste zugelassene Arzneimittel für beide Indikationen, Behandlung und Vorbeugung von Migräne.[6]
Wirksamkeit und Verträglichkeit zur Akutbehandlung der Migräne wurden in einer Studie[7] untersucht. Unter Rimegepant waren 21 Prozent der Probanden zwei Stunden nach der Einnahme schmerzfrei gegenüber nur 11 Prozent in der Placebogruppe.[8] In einer weiteren Studie[9] zur Migräneprophylaxe, in der die Einnahme alle zwei Tage über neun bis zwölf Wochen erfolgte, war die Behandlung mit Rimegepant in Bezug auf den primären Endpunkt (Veränderung der mittleren Anzahl von Migränetagen pro Monat) in diesem Zeitraum gegenüber Placebo überlegen (minus 4,3 Tage unter Rimegepant vs. minus 3,5 Tage unter Placebo).[10]
Als häufigste Nebenwirkung wurde Übelkeit beobachtet.[4]
Pharmakokinetik
BearbeitenNach oraler Gabe beträgt die Bioverfügbarkeit circa 64 %. Maximale Plasmaspiegel entstehen nach 1,5 Stunden. Die Verstoffwechselung erfolgt überwiegend über CYP3A4, in geringerem Maße auch über CYP2C9. Etwa 77 % der Dosis werden unverändert ausgeschieden, davon 51 % über den Urin und 42 % über die Faeces. Die Plasmahalbwertszeit beträgt 11 Stunden.[4]
Handelsnamen
BearbeitenNurtec (USA), Vydura (EU); Zulassungsinhaber: Biohaven Pharmaceuticals
Formuliert ist der Wirkstoff als Schmelztablette (englisch: Orodispersible tablet, ODT) für die Einnahme oder sublinguale Verabreichung.[4] Das Arzneimittel wurde in den USA im Februar 2020[11] und in der EU im April 2022[5] zugelassen.
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 71, World Health Organisation (WHO), 9. März 2014.
- ↑ a b MSDS. InvivoChem LLC, abgerufen am 7. Mai 2022.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Rimegepanthemisulfat-Sesquihydrat: CAS-Nr.: 1374024-48-2, EG-Nr.: 822-372-0, ECHA-InfoCard: 100.257.033, PubChem: 71586738, ChemSpider: 29398960, Wikidata: Q27251488.
- ↑ a b c d e Nurtec ODT, Label , Biohaven Pharmaceuticals, Stand April 2022.
- ↑ a b Eintrag EU/1/22/1645 im EU-Register für Humanarzneimittel, Europäische Kommission. 25. April 2022.
- ↑ Neuartiges Migränemittel in der EU zugelassen, pharmazeutische-zeitung.de, 2. Mai 2022.
- ↑ Klinische Studie (Phase 3): Trial in Adult Subjects With Acute Migraines bei Clinicaltrials.gov der NIH
- ↑ R. Croop, P. J. Goadsby, D. A. Stock, C. M. Conway, M. Forshaw, E. G. Stock, V. Coric, R. B. Lipton: Efficacy, safety, and tolerability of rimegepant orally disintegrating tablet for the acute treatment of migraine: a randomised, phase 3, double-blind, placebo-controlled trial. In: The Lancet. Band 394, 2019, S. 737–745, doi:10.1016/S0140-6736(19)31606-X.
- ↑ Klinische Studie (Phase 2/3): Efficacy and Safety Trial of Rimegepant for Migraine Prevention in Adults bei Clinicaltrials.gov der NIH
- ↑ R. Croop, R. B. Lipton, D. Kudrow, D. A. Stock, L. Kamen, C. M. Conway, E. G. Stock, V. Coric, P. J. Goadsby: Oral rimegepant for preventive treatment of migraine: a phase 2/3, randomised, double-blind, placebo-controlled trial. In: The Lancet. Band 397, 2021, S. 51–60, doi:10.1016/S0140-6736(20)32544-7.
- ↑ Drug Trials Snapshots: Nurtec ODT, FDA, 19. März 2020.