Seladelpar
Seladelpar ist ein Arzneistoff zur Behandlung von primärer biliärer Cholangitis.[3] Es wird als Lysin-Dihydratsalz verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
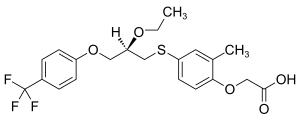
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Seladelpar[1] | |||||||||||||||
| Andere Namen |
2‐(4‐{[(2R)‐2‐Ethoxy‐3‐[4-(trifluormethyl)phenoxy]propyl]sulfanyl}‐2-methylphenoxy)essigsäure (IUPAC) | |||||||||||||||
| Summenformel | C21H23F3O5S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse |
Gallentherapeutika | |||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 444,46 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Seladelpar wurde im August 2024 in den Vereinigten Staaten zur medizinischen Verwendung zugelassen,[4] im Dezember 2024 sprach der Ausschuss für Humanarzneimittel (CHMP) die Zulassungsempfehlung für die EU aus. Der Hersteller ist Gilead Sciences.[5]
Medizinische Anwendung
BearbeitenSeladelpar ist angezeigt zur Behandlung der primären biliären Cholangitis in Kombination mit Ursodeoxycholsäure bei Erwachsenen, die unzureichend auf Ursodeoxycholsäure ansprechen, oder als Monotherapie bei Personen, die Ursodeoxycholsäure nicht vertragen.
Wechselwirkungen
Bearbeiten- Inhibitoren des Organo-Anion-Transporters 3 (OAT3) und starke CYP2C9-Inhibitoren können die Seladepar-Exposition erhöhen.[6]
- Die gleichzeitige Anwendung von Rifampicin kann eine verzögerte oder unzureichende biochemische Reaktion auf Seladelpar bewirken.[6]
- Moderate CYP2C9- und moderate bis starke CYP3A4-Inhibitoren sowie Inhibitoren des Breast Cancer Resistance Proteins (BCRP) (z. B. Ciclosporin) können möglicherweise einen Anstieg der Seladelpar-Exposition bewirken.[6]
- Gallensäure-bindende Harze können die Resorption von Seladelpar herabsetzen und sind mit zeitlichem Abstand einzunehmen.[6]
Klinisch reduziert Seladelpar Pruritus und Interleukin-31 bei Patienten mit primärer biliärer Cholangitis.
Eigenschaften
BearbeitenSeladelpar wirkt als Agonist am Peroxisom-Proliferator-aktivierten Rezeptor delta (PPARδ).[6]
Seladelpar ist ein einzelnes Enantiomer in der der R-Konfiguration. Das pharmazeutisch verwendete Lysin-Dihydrat-Salz ist ein weißes bis cremefarbenes Pulver. Seine Löslichkeit in Wasser ist pH-abhängig: bei niedrigem pH-Wert ist es schwer löslich, bei hohem pH-Wert sehr gut löslich.[6]
Handelsnamen
BearbeitenLivdelzi (USA), Seladelpar Gilead (EU)
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 77. In: who.int. 9. März 2017, abgerufen am 8. Dezember 2024 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ DailyMed. 14 August 2024. Retrieved 5 September 2024. Billin AN (October 2008). "PPAR-beta/delta agonists for Type 2 diabetes and dyslipidemia: an adopted orphan still looking for a home". Expert Opinion on Investigational Drugs. 17 (10): 1465–1471.
- ↑ Center for Drug Evaluation, Research: Drug Trials Snapshots: LIVDELZI. In: fda.gov. 31. Oktober 2024, abgerufen am 8. Dezember 2024 (englisch).
- ↑ Seladelpar Gilead. In: ema.europa.eu. 13. Dezember 2024, abgerufen am 16. Dezember 2024 (englisch).
- ↑ a b c d e f DailyMed - Livdelzi - seladelpar lysine capsule. In: dailymed.nlm.nih.gov. 14. August 2024, abgerufen am 8. Dezember 2024 (englisch).