| Klassifikation nach ICD-10 | |
|---|---|
| D15.0 | Gutartige Neubildung des Thymus |
| C37 | Bösartige Neubildung des Thymus |
| ICD-10 online (WHO-Version 2019) | |

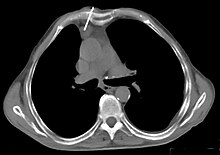

Thymom ist der medizinische Fachausdruck für einen Tumor des Thymus (deutsch auch Bries genannt). Ungefähr drei Viertel dieser Tumoren sind gutartig, und nur ein Viertel ist bösartig. Die bösartigen werden malignes Thymom oder Thymuskarzinom genannt. Im entfernteren Sinne ist auch das Thymuskarzinoid als Geschwulst innerhalb des Thymus zu den bösartigen Thymustumoren zu zählen.
Symptome
BearbeitenEtwa 30 % der Patienten sind zum Diagnosezeitpunkt asymptomatisch.[1] Symptome können unter anderem Husten, Druckgefühl im Brustkorb oder Luftnot sein.
Gelegentlich kann ein Thymom auch durch ein paraneoplastisches Syndrom auffallen. Bei 25 % aller Thymome findet sich eine Myasthenia gravis[2], aber auch eine Polymyositis, eine Arthritis oder ein Sjögren-Syndrom, eine Erythrozytenaplasie, eine Riesenzell-Myokarditis, eine Hypogammaglobulinämie, autoimmune Bewegungsstörungen und andere Autoimmunerkrankungen können auftreten. Ursache ist häufig die fehlende Genexpression des autoimmune regulator genes (AIRE), das die normale Elimination von autoreaktiven T-Lymphozyten im Thymus verstärkt.
Ein Thymuskarzinoid lässt sich durch die karzinoidtypische Trias aus Durchfall, Flush (Erröten) und kardialen Beschwerden vermuten.
Diagnostik
BearbeitenHinweise auf ein Thymom ergeben sich schon im Röntgenbild des Brustkorbes bei Vorliegen einer unklaren vorderen mediastinalen Raumforderung. Es zählt zu den mnemotechnisch oft zitierten vier T’s in der Differentialdiagnostik der vorderen mediastinalen Raumforderungen (Teratom, Thymom, Glandula thyroidea und „terrible lymphoma“). Zur Standarddiagnostik gehört die Computertomographie (CT). Zur Unterscheidung von gutartigen und bösartigen Tumoren ist stets die Entnahme einer Gewebeprobe (Biopsie) und deren feingewebliche Untersuchung nötig.
In der WHO-Klassifikation wird nach dem morphologischen Aussehen der epithelialen Zellen unterteilt:
- Typ A – die epithelialen Zellen sind vorwiegend oval oder spindelförmig und ähneln den normalen medullären epithelialen Zellen des Thymus
- Typ B – die epithelialen Zellen sind vorwiegend rund oder vieleckig und ähneln den normalen corticalen epithelialen Zellen des Thymus. Nach Stärke der zytologischen Atypie werden noch die Typen B1, B2 und B3 unterschieden.
- Typ C – Thymuskarzinom
Behandlung
BearbeitenDie beste Behandlung ist die komplette chirurgische Entfernung des Tumors. Eine unvollständige Entfernung ist mit einer hohen Rezidivrate und einer schlechten Prognose verbunden. Der Eingriff wird entweder über einen Zugang mit Durchtrennung des Brustbeins durchgeführt oder minimalinvasiv mit Operationsrobotern.[3]
Ist die komplette chirurgische Entfernung nicht möglich, kann eine Strahlentherapie angezeigt sein. Sie wird entweder adjuvant oder palliativ durchgeführt.[3]
Eine Chemotherapie wird meist mit Anthracyclin-basierten Protokollen durchgeführt. Dabei kommen CAP (Cyclophosphamid, Doxorubicin und Cisplatin), ADOC (Doxorubicin, Cisplatin, Vincristin und Cyclophosphamid) oder AC (Amrubicin und Carboplatin) zum Einsatz, wobei das CAP-Protokoll das bevorzugte ist.[3]
Die Möglichkeiten einer Immuntherapie sind bislang wenig erforscht, sodass eine abschließende Bewertung ihres Nutzens bislang aussteht. Der monoklonale Antikörper Pembrolizumab konnte bei einem von 40 Patienten eine Remission erzielen. Auch Nivolumab, Framucirumab, Sunitinib und Cixutumumab sind in Einzelstudien getestet worden.[3]
Thymome bei Tieren
BearbeitenAuch bei Tieren ist das Auftreten von Thymomen bekannt, beschrieben sind sie unter anderem bei Hunden, Katzen, Kaninchen und Frettchen. Während sie bei Hunden und Katzen selten sind treten sie beim Kaninchen mit relativ häufig auf. Die Symptomatik ist bei allen Tieren hauptsächlich dominiert von der Raumforderung, die zu einem reduzierten Lungenvolumen führt. Andere Symptome sind speziesspezifisch möglich.
Beim Hauskaninchen machen Thymustumoren etwa 10 % aller Tumoren aus und werden vor allem bei älteren Tieren beobachtet. Im Gegensatz zu anderen Tierarten zeigt der Thymus bei Kaninchen keine Involution, sondern ist auch beim erwachsenen Tieren erhalten. Am häugfigsten sind Thymome, seltener treten auch Thymuslymphome und Thymuskarzinome auf. Thymome metastasieren bei Kaninchen nur selten, führen aber durch die Raumforderung häufig zu schwerwiegenden Symptomen. Zudem werden sie zumeist erst in einem weit fortgeschrittenen Stadium erkannt. Die Symptome entwickeln sich schleichend und unspezifisch zunächst als Konditionsverlust. Typisch sind im weiteren Verlauf ein beidseitiger Exophthalmus infolge einer Hypertonie, Fressunlust, Atemnot, Husten und Abmagerung. Aufwendige chirurgische Eingriffe werden beim Kaninchen eher selten durchgeführt. Daher dominiert die palliative Therapie mit Blutdrucksenkern und Prednisolon. Letzteres kann das Wachstum von Lymphomen hemmen. Die Strahlentherapie ist bei Kaninchen erfolgversprechend.[4][5]
Beim Haushund zählt das Thymom zu den seltenen Tumoren. Auch hier sind die vorherrschenden Symptome Atemnot, Abgeschlagenheit und Husten. Häufig tritt eine Hyperkalzämie und Neutrophilie auf. Die Chirurgie ist mit einem medianen Überleben von 790 Tagen bei oparablen Tumoren die Therapie der Wahl.[6] Metastasen in die regionalen Lymphknoten haben eine bessere Behandlungsaussicht als Fernmetastasen.[7]
Einzelnachweise
Bearbeiten- ↑ I. G. Schmidt-Wolf, J. K. Rockstroh, H. Schüller u. a.: Malignant thymoma: current status of classification and multimodality treatment. In: Ann Hematol. 82 (2), 2003, S. 69–76. PMID 12601482.
- ↑ Margaret Seton, Carol C. Wu, Abner Louissaint: Case 26-2013 — A 46-Year-Old Woman with Muscle Pain and Swelling. In: New England Journal of Medicine. 2013, Band 369, Ausgabe 8 vom 22. August 2013, S. 764–773; doi:10.1056/NEJMcpc1208152.
- ↑ a b c d Teresa Stachowicz-Stencel et al.: Thymoma and thymic carcinoma in children and adolescents:TheEXPeRT/PARTNER diagnostic and therapeutic recommendations. In: Pediatr Blood Cancer Band 68, Suppl. 4, 2021, e29042. doi:10.1002/pbc.29042
- ↑ Andres KM, Kent M, Siedlecki CT, Mayer J, Brandão J, Hawkins MG, Morrisey JK, Quesenberry K, Valli VE, Bennett RA. The use of megavoltage radiation therapy in the treatment of thymomas in rabbits: 19 cases., Vet Comp Oncol. 2012 Jun;10(2):82-94. doi:10.1111/j.1476-5829.2011.00273.x
- ↑ Thymom und Lymphom bei Kaninchen
- ↑ Zitz JC, Birchard SJ, Couto GC, Samii VF, Weisbrode SE, Young GS. Results of excision of thymoma in cats and dogs: 20 cases (1984–2005). J Am Vet Med Assoc. 2008 Apr 15;232(8):1186-92. doi:10.2460/javma.232.8.1186. PMID 18412532
- ↑ A.D. Yaleet al.: Thymic epithelial tumours in 51 dogs: Histopathologic and clinicopathologic findings. In: Vet Comp Oncol. 2021, S. 1–9. doi:10.1111/vco.12705