ATP/ADP-Translokase
ATP/ADP-Translokase (AAC) ist das Protein in der Mitochondrien-Membran von Eukaryoten, das den Transport von ATP aus dem Mitochondrium katalysiert; gleichzeitig wird ADP vom Zytosol hineingeschleust. Der Transport ist essenzieller Bestandteil des Energiestoffwechsels, da ATP überall in der Zelle als Energielieferant benötigt wird.
| ATP/ADP-Translokase | ||
|---|---|---|
| Masse/Länge Primärstruktur | 298–315 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, multipass Membranprotein | |
| Isoformen | 1, 2, 3, 4 | |
| Bezeichner | ||
| Gen-Name(n) | SLC25A4, SLC25A5, SLC25A6, SLC25A31 | |
| Transporter-Klassifikation | ||
| TCDB | 2.A.29.1.2 | |
| Bezeichnung | Mitochondrialer Carrier | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten[1] | |
Im Mensch gibt es vier paraloge Isoformen des Transporters, die in verschiedenen Gewebetypen lokalisiert sind. Mutationen im SLC25A4-Gen, das für AAC1 codiert, sind für eine seltene Erbkrankheit verantwortlich, die mit Ophthalmoplegia progressiva externa (Lähmung der Augenmuskeln) einhergeht.[2]
Die Transportgleichung lautet:
Es handelt sich also um einen Antiporter, und er wird dadurch betrieben, dass ADP bzw. ATP ohne bindende Magnesiumionen transportiert werden. ATP ist bei pH 7 damit vierfach negativ geladen, ADP dreifach negativ. Damit wandert ATP bevorzugt entlang des Membranpotentials aus der Matrix in den IMR.[3]
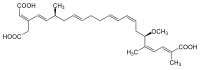
AAC ist ein häufiges Protein der inneren Membran des Mitochondriums und kann bis zu 14 % aller Proteine der inneren Membran ausmachen.[4] Infolgedessen ist es unwahrscheinlich, dass die ATP-Synthese aus Mangel an ADP limitiert ist. Die Translokase kann durch Atractylosid, ein Glykosid, gehemmt werden. Auch Bongkreksäure inhibiert den Translokator[5]. Diese bindet an der Matrixseite des Proteins und muss infolgedessen erst in die Mitochondriummatrix gelangen. Bongkreksäure wird vom Bakterium Pseudomonas cocovenenas ausgeschieden.[6]
Weblinks
Bearbeiten- Jassal / reactome: ADP-ATP translocase maintains a high ADP:ATP ratio in the matrix
- Eintrag zu Ophthalmoplegie, chronische externe progressive, maternal-vererbte. In: Orphanet (Datenbank für seltene Krankheiten)
Einzelnachweise
Bearbeiten- ↑ Homologe bei OMA
- ↑ UniProt P12235
- ↑ Jeremy M. Berg, Lubert Stryer und John L. Tymoczko: Biochemie. Spektrum Akademischer Verlag; 6. Auflage 2007; ISBN 978-3-8274-1800-5; S. 589
- ↑ Thomas M. Devlin (Hrsg.): Textbook of Biochemistry with Clinical Correlations. Wiley & Sons; 6. Auflage 2005; ISBN 0-471-67808-2; S. 570
- ↑ Jonathan J. Ruprecht, Martin S. King, Thomas Zögg, Antoniya A. Aleksandrova, Els Pardon, Paul G. Crichton, Jan Steyaert, Edmund R.S. Kunji: The Molecular Mechanism of Transport by the Mitochondrial ADP/ATP Carrier. In: Cell. Band 176, Nr. 3, 24. Januar 2019, ISSN 0092-8674, S. 435–447.e15, doi:10.1016/j.cell.2018.11.025 (sciencedirect.com [abgerufen am 29. Januar 2019]).
- ↑ Henderson, PJ. und Lardy, HA. (1970): Bongkrekic acid. An inhibitor of the adenine nucleotide translocase of mitochondria. In: J Biol Chem.245(6); 1319–1326; PMID 4245638; PDF(freier Volltextzugriff, engl.)
