| Klassifikation nach ICD-10 | |
|---|---|
| C90.0 | Multiples Myelom |
| ICD-10 online (WHO-Version 2019) | |
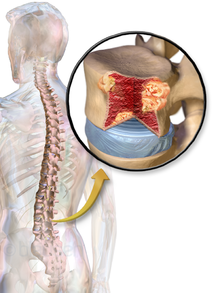
Das Multiple Myelom (MM, häufig synonym verwendet: Plasmozytom; weniger gebräuchlich: Kahler-Krankheit nach Otto Kahler und Huppert-Krankheit nach Karl Hugo Huppert) ist eine Krebserkrankung (Non-Hodgkin-Lymphom) des blutbildenden Systems und wird übergeordnet zu den Monoklonalen Gammopathien gezählt. Sie ist gekennzeichnet durch eine krankhafte (unkontrollierte) Vermehrung Antikörper-produzierender Zellen, den Plasmazellen (ausdifferenzierte B-Zellen). Die entarteten Plasmazellen produzieren in der Regel Antikörper oder Teile/Bruchstücke davon (z.B. freie Leichtketten). Da ein maligner Plasmazellklon von einer gemeinsamen Vorläuferzelle abstammt, sind sie genetisch weitgehend identisch und produzieren ebenso identische (= monoklonale) Antikörper. Nah verwandt aber abzugrenzen vom Multiplen Myelom sind die Plasmazell-Leukämie, das extramedulläre Plasmozytom und das solitäre Plasmozytom.[1]
Dem Multiplen Myelom geht immer eine Monoklonale Gammopathie unklarer Signifikanz (MGUS) voraus.[2][3] Eine MGUS muss nicht zwangsläufig zu einer malignen Erkrankung führen. Häufig gehen aber verschiedene Komorbiditäten auch ohne die Entwicklung einer hämatologischen Erkrankung einher.[4] Als Übergangsstufe zwischen MGUS und MM gilt das schwelende Multiple Myelom (smouldering myeloma; SMM).[5] Der Grad der Malignität eines MM kann sehr unterschiedlich sein und reicht von einem nur langsam fortschreitenden MM bis hin zu einer aggressiven, schnell fortschreitenden Verlaufsform, die häufig durch entdifferenzierte, plasmoblastische Plasmazellen gekennzeichnet ist.
Terminologie
BearbeitenDas Multiple Myelom zählt zu den indolenten (niedrig-malignen) B-Zell-Non-Hodgkin-Lymphomen.[6] Vom echten Multiplen Myelom ist der Begriff Plasmozytom abzugrenzen, der nur ein isoliertes Myelom bezeichnet, bei dem die Erkrankung auf einen einzigen lokalen Krankheitsherd (in der Regel eine Osteolyse = lokale Knochenauflösung) begrenzt ist. Im allgemeinen klinischen Sprachgebrauch hat sich allerdings eine weitgehend synonyme Verwendung der beiden Begriffe verbreitet, weshalb mit Plasmozytom häufig ein Multiples Myelom gemeint ist. Abzugrenzen vom Multiplen Myelom/Plasmozytom sind die Vorstufen Schwelendes Multiples Myelom (SMM) sowie die Monoklonale Gammopathie unklarer Signifikanz (MGUS), bei denen ebenfalls eine klonale Immunglobulinproduktion vorliegt. Symptome und Komplikationen können aber auch schon bei den Vorstufen auftreten, was jedoch aufgrund fehlender Kriterien nicht zwangsläufig zur Diagnose Multiples Myelom führt. Um eine differenziertere Beurteilung der Patienten zu ermöglichen, wurde für Patienten mit nephrologischen Komplikationen, welche auf eine klonale Immunglobulinproduktion krankhaft veränderter Plasmazellen zurückzuführen sind, der Terminus Monoklonale Gammopathie renaler Signifikanz (MGRS) eingeführt.[7] Weitere Monklonale Gammopathien, die nicht als Multiples Myelom bezeichnet werden, sind die AL-Amyloidose (diese kann aber auch zusätzlich zu einem Multiplen Myelom auftreten) und der Morbus Waldenström. Seit einiger Zeit wird aufgrund der Komplexität der Erkrankung(en) und der teilweise schwer abzugrenzenden Vorstufen sowie nahverwandten Entitäten eine Reform der Terminologie diskutiert. Hierbei soll zwischen einer Monoklonalen Gammopathien, bei der eine Behandlung notwendig ist, und einer solchen, die ohne Komplikationen nur unter Beobachtung steht, unterschieden werden.[8]
Epidemiologie
BearbeitenDie Inzidenz des Multiplen Myeloms liegt bei etwa 4–6 Neuerkrankungen/100.000 Personen pro Jahr. Dies entspricht 10 % aller hämatologischen Krebserkrankungen bzw. 1 % aller Krebserkrankungen insgesamt.[10][11] Sie ist eine Erkrankung des höheren Lebensalters, wobei das mediane Alter zum Zeitpunkt der Diagnosestellung bei 66 Jahren liegt. Nur 2 % der Patienten sind jünger als 40 Jahre. Bei Kindern tritt es sehr selten auf.[12] Männer sind etwas häufiger als Frauen betroffen und bei Afroamerikanern kommt die Erkrankung im Vergleich zur weißen US-amerikanischen Bevölkerung etwa doppelt so häufig vor. Im Jahr 2012 lebten weltweit 229.468 Patienten mit einem Multiplen Myelom.[13]
Entsprechend dem gebildeten Antikörper werden folgende Typen unterschieden:[14][15][16]
| Monoklonales Tumorprodukt | Häufigkeit | IgG | IgA | IgM | IgD | IgE | Kappa | Lambda | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Ausschließlich intaktes Immunglobulin | 5 - 10 % | ca. 55 %* | ca. 20 %* | ca. 0,5 %* | ca. 2 %* | extrem selten | ||||
| Freie Leichtkette mit oder ohne intaktem Immunglobulin | 90 - 95 % | Freie Leichtkette mit intaktem Immunglobulin | 70 - 75 % | 57 %* | 34 %* | |||||
| Ausschließlich freie Leichtkette | 15 - 20 % | |||||||||
| Nicht-sekretorisch | 1 - 2 % | |||||||||
| *bezogen auf die Gesamtheit der Myelom-Patienten | ||||||||||
Wichtig ist hervorzuheben, dass bei einem Myelom, bei dem ein intaktes Immunglobulin gebildet wird, z.B. bei einem IgG-Myelom, in ca. 90-95 % der Fälle auch eine freie Leichtkette in erhöhter Menge vorliegt (z.B. eine freie Leichtkette vom Typ κ bei einem IgGκ-Myelom). Bei nur 5-10 % der Fälle findet sich ausschließlich ein intaktes Immunglobulin und in wenigen Fällen scheiden die Plasmazellen kein monoklonales Immunglobulin bzw. keine freie Leichtketten aus.[14] In diesen Fällen spricht man von einem sogenannen nicht-sekretorischen Multiplen Myelom. Monoklonale Immunglobuline werden zum Teil produziert, verbleiben aber daraufhin innnerhalb der Plasmazelle und können nur durch immunzytochemische Methoden (intrazelluläre Anfärbung) nachgewiesen werden. Selten finden sich zudem Fälle, bei denen die Plasmazellen weder intakte Immunglobuline noch freie Leichtketten produzieren (sog. echtes nicht-sekretorisches Multiples Myelom).[17]
Pathogenese
BearbeitenRisikofaktoren
BearbeitenDie pathogenetischen Ursachen des Multiplen Myeloms sind Bestandteil aktueller Forschung. Diskutiert werden Einflüsse verschiedener Umweltfaktoren. So werden mit der Entstehung der Erkrankung ionisierende Strahlung, Herbizide (z.B. Glyphosat), Übergewicht, Autoimmunerkrankungen und gehäufte entzündliche Prozesse sowie Infektionen in Verbindung gebracht. Zum Teil wurden verschiedene genetische Translokationen beschrieben, deren Einfluss aber noch nicht gänzlich geklärt ist.[4] Auch ein Zusammenhang mit der konventionellen Gasförderung oder beim Fracking entstehenden Emissionen werden vermutet.[18]
Entwicklung
BearbeitenDer Übergang von einer Monoklonalen Gammopathie unklarer Signifikanz zum symptomatischen Myelom verläuft in vielen aufeinanderfolgenden Schritten und kann wenige Monate bis mehrere Jahrzehnte dauern, in deren Zeit sich bereits die ersten Organschäden und Symptome ausbilden können.[19] Die maligne Entartung der Myelom-Zellen findet meist außerhalb des Knochenmarks in Keimzentren peripherer lymphatischer Organe statt. Die B-Zellen, die in diese Keimzentren eintreten, haben schon die ersten Differenzierungschritte (V(D)J-Rekombination) hinter sich. In diesem Stadium treten die genetischen Veränderungen ein, die letztlich zur Entstehung des Multiplen Myeloms führen.
Bei den meisten Patienten beobachtet man Translokationen, die bewirken, dass ein Onkogen unter die Kontrolle eines regulatorischen Gens gelangt und somit stark aktiviert wird. Beim Multiplen Myelom ist dies am häufigsten (ca. 80 %) das Immunglobulin-Enhancer-Gen auf Chromosom 14 Genlocus q31. Häufige Partner dieser Translokation sind Teile der Chromosomen 4 (4p16.3; Fibroblast Growth Factor Receptor), 6 (6p21; Cyclin D3), 11 (Bcl-1, Cycin D1), 16 (16q23; C-maf) und 20 (20p11; maf8). Selten findet man 8q24 (c-myc) und noch seltener 18q21 (bcl-2), 11q23 (MLL-1) sowie 20q11 (maf B).[4] Im weiteren Verlauf der Erkrankung treten noch andere genetische Veränderungen auf. Die unterschiedlichen genetischen Veränderungen gehen mit unterschiedlichen Krankheitsverläufen einher und definieren unter Umständen eigene Entitäten. Durch den Nachweis bestimmter genetischer Veränderungen in Myelom-Zellen eines Patienten können in manchen Fällen Aussagen zur Prognose gemacht werden. So weiß man beispielsweise, dass eine Deletion (del13q) oder eine Monosomie von Chromosom 13 ein Hinweis auf eine kürzere Überlebenszeit sein kann.[20] Nach der klonalen Vermehrung einer entarteten Plasmazelle kommt es zur Infiltration des Knochenmarks mit anschließender Zerstörung des Knochens und Verdrängung der normalen Hämatopoese (Blutbildung). Hierbei scheiden die malignen Zellen Wachstumsfaktoren und Zytokine aus, welche die Osteoklasten aktivieren (u. a. OAF), was letztlich zu einem Knochenabbau führt.[21] Die von den malignen Zellen gebildeten Antikörper oder Antikörperteile (freie Leichtketten oder Bruchstücke der schweren Kette), welche sich im Körper anreichern, sind für viele Symptome und Komplikationen der Erkrankung verantwortlich.
Symptome
BearbeitenBei einigen Patienten wird die Erkrankung zufällig im Rahmen einer Blutuntersuchung anhand einer auffälligen Serumproteinelektrophorese diagnostiziert. Bei den meisten Patienten treten jedoch Symptome und Komplikationen auf:[22]
- Unspezifische Symptome wie Schwäche, Müdigkeit und Gewichtsverlust
- Insgesamt entwickeln etwa 60 % der Patienten Knochenveränderungen:
- Starker Knochenabbau/-schäden durch Osteolyse (die Schäden wirken im Gegensatz zu Knochenmetastasen wie ausgestanzt - typisch: Schrotschussschädel)
- Durch die Osteolyse bedingte sekundäre Osteoporose (nicht zu verwechseln mit der primären Form)
- Durch die Osteolyse bedingte Knochenschmerzen und Knochenbrüche
- Verminderung der Knochenmarksfunktion (Knochenmarkinsuffizienz) mit Blutarmut (Anämie) und Neigung zu Blutungen sowie Verminderung der weißen Blutkörperchen (Leukopenie) und/oder der Blutplättchen (Thrombozytopenie) mit Neigung zur Thromboembolie
- Infektanfälligkeit durch Mangel polyklonaler Antikörper und Mangel an weißen Blutkörperchen (Leukopenie)
- Erhöhte Viskosität des Serums durch monoklonale Immunglobuline kann zu Kopfschmerzen, Benommenheit, Schwindel, Nystagmus, Hör- und Sehstörungen, Schläfrigkeit, Koma und Krampfanfällen führen (Hyperviskositätssyndrom)
- Unter Umständen Ablagerungen monoklonaler Immunglobuline oder freier Leichtketten im peripheren Nervensystem (Polyneuropathie)
- Chronisches oder akutes Nierenversagen.[23] Ist die Störung der Nierenfunktion auf eine monoklonale freie Leichtkette oder ein monoklonales intaktes Immunglobulin zurück zu führen, kann von einer Monoklonalen Gammopathie renaler Signifikanz gesprochen werden.[7] Beispiele sind (Auswahl):
- Cast-Nephropathie: In den Nierenkanälchen kann es in Gegenwart von Uromodulin zu Ausfällungen der freien Leichtketten in Form von Eiweißzylindern kommen. Diese Ausfällungen wirken direkt toxisch auf die Zellen der Nierenkanälchen und können zu einem raschen Verlust der Nierenfunktion (akutes Nierenversagen) führen (klassische Myelomniere; auch als Cast-Nephropathie bekannt).
- Leichtketten-Ablagerungs-Krankheit: Ablagerung von Leichtketten in den Basalmembranen von Nierenkörperchen und Nierenkanälchen kann zur Leichtketten-Ablagerungs-Krankheit (light-chain deposition disease) führen. Diese äußert sich in einer stark vermehrten Ausscheidung von Eiweiß im Urin (nephrotisches Syndrom) und führt zu einem chronisches Nierenversagen.
- Fanconi-Syndrom: Die Leichtketten können zu Funktionsstörungen der Zellen im Hauptstück der Nierenkanälchen führen. Diese Funktionsstörungen äußern sich in einer verminderten Ausscheidung von Säuren (Azidose) sowie einem vermehrten Verlust von Phosphat, Glukose, Harnsäure und Aminosäuren.
- AL-Amyloidose: Durch Fehltfaltung freier Leichtketten kommt es zur Bildung von Fibrillen, die sich in Form von Amyloiden in Nierengewebe und Nierengefäßen ablagern. Folge sind wie bei der Leichtketten-Ablagerungs-Krankheit erhöhte Proteinurie und ein chronisches Nierenversagen.
Die typische aber zugleich auch unspezifische Symptomatik erschwert eine eindeutige Diagnose. Viele der hier beschriebenen Symptome können auch in einem früheren Krankheitszustand auftreten und müssen sich nicht zwangsläufig erst bei einem per Definition Multiplen Myelom ausbilden. Eine umfassende Anamnese des Patienten ermöglicht eine sichere Diagnose der zugrundeliegenden Erkrankung. Unter Patienten mit bekannten Vorerkrankungen, wie Osteoporose oder Polyneuropathie, kann mit einer erhöhten Wahrscheinlichkeit eine Monoklonale Gammopathie wie das Multiple Myelom vorliegen.[4][24][25] Im nächsten Abschnitt sind die aktuell gültigen Empfehlungen zur Diagnose und die diagnostischen Kriterien zusammengefasst.
Diagnose
BearbeitenDiagnostische Kriterien
BearbeitenAls Grundvoraussetzung gilt eine ≥10 %ige Infiltration des Knochenmarks durch klonale Plasmazellen oder ein durch Biopsie bestätigtes extramedulläres Plasmozytom. Wird zusätzlich eines oder mehrere der folgenden Kriterien erfüllt, kann die Diagnose Multiples Myelom gestellt werden:[26]
- CRAB-Kriterien
- Hyperkalzämie im Serum nachweisbar mit einem Wert von > 2,75 mmol/l oder > 0,25 mmol/l oberhalb des oberen Normwertes.
- Niereninsuffizienz, definiert als Serumkreatinin > 2 mg/dl oder einer Kreatinin-Clearance < 40 ml/min.
- Anämie, definiert als Hämoglobinwert von < 10 g/dl oder mehr als 2,0 g/dl unter dem Normwert.
- Knochenläsionen mit mindestens einer osteolytischen Läsion, nachweisbar durch Röntgen, CT oder PET-CT.
- SLiM-Kriterien
- ≥ 60 %ige Infiltration von Plasmazellen im Knochenmark.
- eine Freie-Leichtketten-Ratio der tumorassoziierten freien Leichtkette (involvierte freie Leichtkette) zur nicht-tumorassoziierten freien Leichtkette (nicht involvierte freie Leichtkette) von ≥ 100 (wobei die tumorassoziierte freie Leichtkette mit einer Konzentration von mindestens 100 mg/l vorliegen muss).
- > 1 fokale Knochenläsion mit einer Größe von mindestens 5 mm nachgeweisen durch eine Ganzkörperaufnahme im MRT.
Differentialdiagnose
BearbeitenUm die Diagnose anhand der oben genannten Kriterien stellen zu können, müssen verschiedene Untersuchungen durchgeführt werden. In den internationalen wie nationalen Leitlinien finden hierbei folgende Methoden Erwähnung:[22][26]
| 1. Labordiagnostik | 2. Bildgebung | 3. Untersuchung des Knochenmarks |
|---|---|---|
|
Als Standardmethoden gelten:
Außerdem:
|
|
|
Wird durch die oben genannten Untersuchungen ein positiver Befund erzielt bzw. CRAB-/SLiM-Kriterien erfüllt, sind folgende zusätzlichen Untersuchungen vor Einleitung einer Therapie in Betracht zu ziehen:
- Magnet-Resonanz-Tomographie (MRT) gezielter Regionen, ggf. mit Kontrastmittel), insbesondere bei
- neurologischer Symptomatik mit Verdacht auf Myelonkompression
- Verdacht auf extramedulläre Manifestationen
- Echokardiographie bei (v.a. kardiale Amyloidose)
Differentialdiagnostisch abzugrenzen sind neben reaktiven Knochenmarksveränderungen auch die Vorstufen SMM und MGUS siehe hierzu die allgemeinen Diagnosekriterien Monoklonaler Gammopathien.
Prognose
BearbeitenViele verschiedene Faktoren spielen eine Rolle bei der Entwicklung der Krankheit und in deren Verlauf. So z. B. das Alter bei Krankheitsbeginn, die körperliche Allgemeinverfassung, das Ausmaß der begleitenden Erkrankungen, das Auftreten von Komplikationen oder unvorhergesehenen Ereignissen und/oder das Ansprechen auf die Behandlungsmaßnahmen. Die Überlebensraten haben sich innerhalb der letzten zehn Jahre laut Hartmut Goldschmidt durch die neuen Therapiemöglichkeiten (s. u.) signifikant verbessert.[27] Sie können das Gesamtüberleben und die beschwerdefreie Zeit verlängern. Nicht zuletzt erhöhen sie die Lebensqualität von Betroffenen und Angehörigen.[28] Zusammengefasst kann nach aktuellem Stand von einer absoluten 5-Jahres-Überlebensrate von 41 % für Männer bzw. 40% für Frauen gesprochen werden. Unter Berücksichtigung der Sterblichkeit in der Allgemeinbevölkerung liegt die relative 5-Jahres-Überlebensrate aktuell bei 48 % für Männer bzw. 45 % für Frauen. Für Männer bzw. Frauen liegt die jeweilige relative 10-Jahres-Überlebensrate bei 31 % bzw. 30 %.[22] Durch eine Einteilung in Stadien sowie eine Risikostratifizierung können Patienten differenzierter beurteilt und eine genauere Prognose gestellt werden.
Stadieneinteilung
BearbeitenDie nach wie vor gängige Einteilung nach Brian Durie und Sydney Salmon unterscheidet 3 Stadien:[29]
| Stadium | Merkmale |
|---|---|
| Stadium I |
|
| Stadium II | zwischen Stadium I und III |
| Stadium III | mindestens eines der folgenden Kriterien:
|
| Zusatz A B |
|
Neuer ist die Einteilung nach dem International Staging System (ISS), bei der nur β2-Mikroglobulin und Albumin berücksichtigt werden.[30]
| Stadium | Merkmale |
|---|---|
| ISS I | β2-Mikroglobulin < 3,5 mg/l und Albumin ≥ 35 g/l |
| ISS II | β2-Mikroglobulin < 3,5 mg/l und Albumin < 35 g/l oder β2-Mikroglobulin 3,5–5,5 mg/l |
| ISS III | β2-Mikroglobulin > 5,5 mg/l |
Risikostratifizierung
BearbeitenSollte bereits vor Ausbildung der Erkrankung die Vorstufe MGUS diagnostiziert worden sein, können folgende Faktoren zur Beurteilung eines Risikos zur Ausbildung eines symptomatischen Multiplen Myeloms herangezogen werden:[31]
- abnormale Ratio der freien Leichtketten
- M-Protein im Serum > 15 g/l
- M-Protein vom Typ IgA, IgM, IgD oder IgE
Unter Berücksichtigung der durchschnittlichen Lebenserwartung kann von einem 2 %igen Risiko bei Abwesenheit aller Faktoren, bei Nachweis von einem Faktor von einem 10 %igem Risiko, einem 18 %igen Risiko bei Nachweis von zwei Faktoren und einem 27 %igem Risiko bei Nachweis von allen drei Faktoren zur Weiterentwicklung der MGUS zum Multiplen Myelom innerhalb von 20 Jahren ausgegangen werden.[4][31] Werden anschließend regelmäßige Untersuchungen der betroffenen Patienten durchgeführt (je nach Risikoeinstufung alle 6 Monate, jährlich oder alle 2 bis 3 Jahre) kann das Risiko von Komplikationen durch das Fortschreiten der Erkrankung bzw. Vorstufe vermindert werden.[32]
Auf ähnliche Art und Weise können auch Patienten mit einem bereits nachgewiesenen schwelenden Multiplen Myelom anhand folgender Faktoren für ein ca. 50 %iges Risiko einer Progression innerhalb von 2 Jahren eingestuft werden. Grundvoraussetzung sind mindestens 10 % klonale Plasmazhellen im Knochenmark und ein oder mehrere der folgenden Kriterien:
- Anstieg des M-Proteins im Serum in zwei aufeinanderfolgenden Messungen um mindestens 25 %
- M-Protein im Serum von mindestens 30g/l
- Ratio der tumorassozierten zur nicht tumorassoziierten freien Leichtkette mindestens 8
- SMM vom Typ IgA
- Supression zweier nicht tumorassoziierter Immunglobulin-Isotypen
- Erhöhte Zahl zirkulierender Plasmazellen
- Zytogenetische Abnormalitäten der Chromosomen 4, 14 und 17
- Nachweis durch PET-CT oder MRT von fokalen Läsionen (mindestens eine) ohne osteolytische Knochenschäden
- 50-60% klonale Plasmazellen im Knochenmark
Eine abnormale Ratio der freien Leichtketten, ein M-Protein im Serum von mindestens 30 g/l und klonale Plasmazellen im Knochenmark von mindestens 10 % gelten als unabhängige Risikofaktoren.[31] Nach 5 Jahren liegt das Progressionsrisiko bei Anwesenheit einer dieser Faktoren bei 25 %, bei Anwesenheit von zwei Faktoren bei 51 % und bei Anwesenheit aller drei Faktoren bei 76 %. Die empfohlenen Nachuntersuchungsintervalle sind alle 2-3 Monaten, bei stabilen Werten im 1. Jahr nach Diagnosestellung alle 4-6 Monate und anschließend bei unverändert stabilen Werten alle 6-12 Monate.
Therapie
BearbeitenBis zum heutigen Stand der Wissenschaft ist eine Heilung des Multiplen Myeloms nicht möglich. Regelmäßige Labortests sowie Röntgen- und Knochenmarkuntersuchungen informieren über den Verlauf der Erkrankung. Eine Einleitung der Therapie ist erforderlich, wenn sich Endorganschädigungen (CRAB- und SLiM-Kriterien - siehe oben) zeigen.[33] Es gibt inzwischen zahlreiche Behandlungsmöglichkeiten, die den Erkrankungsstand über einen längeren Zeitraum stabil halten, die Beschwerden mindern und die Lebensqualität für die Betroffenen deutlich erhöhen können.
Therapie der Primärerkrankung
BearbeitenBetroffene können, je nach Möglichkeit und Indikation, mit Chemotherapie, Medikamenten, die das Immunsystem beeinflussen (Immunmodulatoren), und solchen, die die Knochenauflösung hemmen (Bisphosphonate) behandelt werden sowie eine Knochenmarktransplantation erhalten. Die Überlebensraten haben sich innerhalb der letzten zehn Jahre durch neue Medikamente wie Bortezomib, Carfilzomib, Ixazomib, Lenalidomid, Panobinostat, Pomalidomid und Thalidomid signifikant verbessert.[28][34][35][36] Die Primärtherapie wird für jeden Patienten immer individuell festgelegt. Ganz wesentlich beeinflusst z. B. das Alter die Therapieentscheidung. Auch die körperliche Allgemeinverfassung und das Ausmaß der begleitenden Erkrankungen spielen eine große Rolle, welche Therapie als geeignet angesehen werden kann. Theoretisch kommen folgende Möglichkeiten infrage, wobei ein höheres Alter z. B. eine Stammzelltransplantation ausschließt:[28][34][35]
Chemotherapie
BearbeitenDie klassische Kombinationstherapie besteht aus dem Zytostatikum Melphalan und dem Cortison-Präparat Prednison. Die Chemotherapie läuft üblicherweise in Zyklen ab. Bekannte und gefürchtete Nebenwirkungen sind Haarverlust und Übelkeit. Diese Nebenwirkungen können heute jedoch durch wirksame Medikamente gemildert oder ganz vermieden werden. Ein weiteres Chemotherapeutikum ist Bendamustin, das sich durch ein günstigeres Nebenwirkungsprofil auszeichnet.
Autologe Stammzelltransplantation
BearbeitenHierbei handelt es sich um die Transplantation von eigenen Stammzellen. Dabei werden Stammzellen aus dem Knochenmark des Patienten gewonnen und nach erfolgter Chemotherapie dem Patienten wieder zurückgegeben. Diese Stammzellen führen meist innerhalb von kurzer Zeit zur Regeneration der Blutbildung.
Allogene Stammzelltransplantation
BearbeitenBei dieser wesentlich selteneren Methode werden Stammzellen eines fremden Spenders transplantiert. Für dieses Verfahren müssen die Patienten bestimmte Voraussetzungen mitbringen. Das blutbildende System des Empfängers wird nachhaltig zerstört, um durch die Gabe von möglichst identischen Blutstammzellen ein neues hämatopoetisches System zu schaffen, welches frei von kranken Blutzellen ist. Im Gegensatz zur autologen Übertragung besteht zwar grundsätzlich die Gefahr der Transplantat-gegen-Wirt-Reaktion (Graft-versus-Host disease), allerdings kann dieses Phänomen auch den positiven Effekt der Graft-versus-Malignom-Reaktion (Graft-versus-Malignom-Effekt) mit sich bringen. Die Patienten müssen bis zu einem Jahr Medikamente zur Unterdrückung der Abstoßungsgefahr (Immunsuppressiva) einnehmen. Die allogene Stammzelltransplantationist die einzige "Organtransplantation", bei der die Immunsuppressiva nicht lebenslang eingenommen werden müssen.
Strahlentherapie
BearbeitenIm Gegensatz zu einer Chemotherapie wirkt eine Strahlentherapie lokal. Mit ihrer Hilfe soll die Teilungsfähigkeit der bösartigen Zellen gestoppt und dadurch das weitere Wachstum des Tumors verhindert werden. Als Nebenwirkungen können Hautrötungen, Durchfall und Erbrechen auftreten.
Immunmodulation
BearbeitenImmunmodulierende Substanzen (IMiDs für den englischen Begriff: Immunomodulatory Imid Drugs) haben sich in den vergangenen Jahren als ausgesprochen wirksames Mittel gegen Krebserkrankungen erwiesen. Dabei wird die Ausschüttung von entzündungs- oder tumorfördernden Stoffen gehemmt. Zu den IMiDs gehören: Lenalidomid (Handelsname: Revlimid) und Thalidomid; Pomalidomid ist in den USA unter dem Handelsnamen Pomalyst auf dem Markt. In Europa wurde Pomalidomid im August 2013 mit dem Handelsnamen Imnovid zugelassen.[37][38]
Anders als beispielsweise eine Chemotherapie, bei der neben der Zerstörung des Tumorgewebes die vorübergehende Beeinträchtigung der gesunden Zellen unvermeidlich ist, wirken IMiDs gezielt gegen die tumorauslösenden Prozesse. Für die Behandlung von Patienten, die mindestens eine vorausgegangene Therapie erhalten haben, wurde von der Europäischen Arzneimittelagentur (EMA) im Juli 2007 die perorale Lenalidomid Darreichungsform (Revlimid Hartkapseln, Celgene) in Kombination mit Dexamethason zugelassen. Es wurde als sogenanntes Arzneimittel für seltene Leiden (Orphan-Arzneimittel) eingestuft. In Kombinationstherapie mit Dexamethason ist es bei Rückfällen oder Therapieversagen effektiver als eine Monotherapie mit Dexamethason.[39] Lenalidomid verfügt neben der immunmodulierenden Wirkung über weitere Mechanismen der Tumorbekämpfung:[40]
- Aktivierung von Immunzellen (T-Zellen und natürliche Killerzellen, die ihrerseits die Tumorzellen angreifen)
- Wachstumsstopp durch direkten Angriff auf die Tumorzellen
- Angiogenesehemmung (Hemmung der Neubildung von Blutgefäßen, welche den Tumor mit Nährstoffen versorgen)
- Unterdrückung der Freisetzung von tumorfördernden Botenstoffen
- Apoptose durch Zellzyklus-Arrest
- Hemmt Osteoklasten-Aktivierung
Proteasominhibition
BearbeitenProteasomen sind Eiweißkomplexe, die das Wachstum und das Absterben der Zellen (Apoptose) regulieren. Proteasominhibitoren sind Substanzen, die die Aktivität von Proteasomen hemmen (inhibieren). Sie bewirken eine Verlangsamung des Zellwachstums und eine Beschleunigung der Apoptose. Der erste sowohl in den USA als auch in der EU zugelassene Proteasominhibitor ist Bortezomib (Handelsname: Velcade); Carfilzomib (Handelsname: Kyprolis) wurde 2015 sowohl in den USA als auch in der EU zugelassen.[41] Ixazomib ist in der EU seit 2016 zugelassen.[42] Als Wirkverstärker von Proteasominhibitoren ist der Histon-Deacetylase-Hemmer Panobinostat (Handelsname: Farydak) seit 2015 in der EU zur Behandlung des Multiplen Myeloms unter bestimmten Voraussetzungen zugelassen.[43][36]
Biologika
BearbeitenNeuere Forschungen haben zur Entwicklung hochspezifischer Biologika geführt, die seit einiger Zeit für die Therapie des Multiplen Myeloms zugelassen sind. Darunter die monoklonalen Antikörper Daratumumab und Elotuzumab. Während Daratumumab spezifisch an das Glykoprotein CD38 bindet, welches auf Myelomzellen überexprimiert vorliegt, wodurch die Apoptose der Zellen ausgelöst wird,[44][45] entfaltet Elotuzumab seine immunstimulatorischen Eigenschaften durch die Interaktion mit dem Oberflächenprotein SLAMF7 auf Myelomzellen.[46]
Supportivtherapie
BearbeitenErgänzende (sogenannte supportive) therapeutische Maßnahmen können helfen, begleitende Symptome einzudämmen und Komplikationen vorzubeugen.
Verlaufskontrolle
BearbeitenAnhand verschiedener Parameter kann die Effektivität einer Therapie beurteilt werden. Nachfolgend sind die aktuell gültigen Definitionen aus internationalen und nationalen Leitlinien aufgelistet, die hierbei Anwendung finden.[47]
Remmisionskriterien
Bearbeiten| Kriterium/Status | M-Protein in SPE | M-Protein in IFE | Freie Leichtketten | Manifestation in Weichteilen | Anteil Plasmazellen im Knochenmark |
|---|---|---|---|---|---|
| Stringente komplette Remission (sCR) | Nicht nachweisbar in Serum und Urin | Normalisierte Ratio der freien Leichtketten | Keine nachweisbar | ≤ 5 %; keine klonalen Plasmazellen nachweisbar durch Immunhistochemie | |
| Komplette Remission (CR) | Nicht nachweisbar in Serum und Urin | Keine nachweisbar | ≤ 5 % | ||
| Sehr gute partielle Remission (VGPR) | Mind. 90 % Reduktion im Serum und weniger als 100 mg/24h im Urin oder kein M Protein in Serum und Urin nachweisbar | Nachweisbar | |||
| Partielle Remission (PR) | Mind. 50% Abnahme im Serum und mind. 90 % Reduktion im Urin oder weniger als 200 mg/24h im Urin | Falls M-Protein nicht bestimmbar gilt > 50 % Reduktion der Differenz aus tumorassoziierter (involvierter) und nicht-tumorassozierter (nicht-involvierter) freier Leichtkette = dFLC | > 50 % Reduktion (obligates Kriterium) | Falls Anteil vor Therapie über 30 % und falls M-Protein und freie Leichtketten Ratio nicht bestimmbar gilt eine Reduktion der Infiltration um über 50 % | |
| Stabile Erkrankung (SD) | Keinerlei der Kriterien erfüllt | ||||
| Progressive Erkrankung (PD) | Mind. 25 % Anstieg im Serum und absolut mind. 0,5 g/dl und/oder mind. 25 % Anstieg im Urin oder absolut ≥ 200 mg/24h | Mind. 25 % Anstieg der dFLC im Serum, absolut um mindestens 100mg | Progress oder Neuauftreten | > 25 % Anstieg in Bezug auf den Wert zum Zeitpunkt des besten Ansprechens und absolut mind. 10 % | |
Minimale Resterkrankung (MRD)
BearbeitenBei einer großen Mehrheit der Patienten ist auch nach Erreichen einer kompletten Remission mit verschiedenen Methoden eine minimale Resterkrankung (im Englischen als minimal residual disease (MRD) bezeichnet) nachweisbar.[48] In einem solchen Fall ist der Patient dabei nicht als geheilt zu betrachten und unter Umständen kann es im späteren Verlauf zu einem Rezidiv kommen. Zwischenzeitlich etablierte Methoden zum Nachweis einer Resterkrankung sind Next-Generation-Sequencing, Durchflusszytometrie sowie MRT und PET.[47] Neuere Studien zeigen außerdem, dass durch die serologische Bestimmung der Immunglobuline, entsprechend ihrer gebundenen Leichtkette, Aussagen über eine möglicherweise zugrundeliegende minimalen Resterkrankung getroffen werden kann - z.B. IgGκ als M-Protein im Normbereich und IgGλ als normales (polyklonales) Immunglobulin unterhalb des Normebreichs als Hinweis für eine MRD.[49][50] Bei einer nachgewiesenen MRD-Negativität, ist von einem längeren progressionsfreien als auch Gesamtüberleben auszugehen.[51] Diese Methoden sind aktuell noch kein Standard und tragen zur Zeit noch nicht prädiktiv für weitere Therapieentscheidungen bei.
Geschichte des Multiplen Myeloms
BearbeitenDas Multiple Myelom ist keine Erscheinung der Neuzeit, bereits seit vielen Jahrhunderten werden Menschen von dieser Erkrankung heimgesucht. So weisen schon Knochenfunde aus dem 2. Jahrhundert v. Chr. die typischen zerstörerischen Merkmale der Erkrankung auf.[53]
Historischer Fallbericht: Thomas McBean (1850):
Der erste gut dokumentierte Fall eines Multiplen Myeloms geht auf einen Fallbericht von Macintyre zurück.[54][55] Er beschrieb die Krankheitsgeschichte des englischen Gemischtwarenhändlers Thomas A. McBean, welcher sich 1845 im Alter von 45 Jahren in seiner Arztpraxis vorgestellt hatte. McBean beklagte, dass etwas mit seinem Urin nicht stimmte – er verspürte häufig Harndrang, und sein „Leibkleid wurde durch den Urin ganz steif“, obwohl er keinen Ausfluss aus der Harnröhre bemerkt hatte. Außerdem litt der Patient an ungewöhnlicher Schwäche und Ausgezehrtheit, während eines Spaziergangs habe er dann das Gefühl gehabt, „etwas im Brustkorb knackte oder gab nach“, und McBean stürzte und konnte sich „wegen starker Schmerzen für einige Minuten nicht mehr erheben“. Doktor Macintyre behandelte den Patienten mit einer Bandage des Brustkorbes („strengthening plasters“) und verordnete körperliche Schonung.[54] Einen Monat später hatte der Patient erneut starke Schmerzen, woraufhin man wiederholte Aderlässe, Blutegelbehandlungen und Schröpfkegel einsetzte, was jedoch keine dauerhafte Linderung brachte, so dass sich McBean bei einem anderen Arzt, Dr. Watson, vorstellte. Dieser begann eine Behandlung mit Eisen und Chinin, was zu einer erstaunlichen Besserung führte, die ein halbes Jahr anhielt. Im Oktober 1845 erlitt der Patient jedoch starke Schmerzen an der Wirbelsäule und dem Ischias, welche sich auch durch den Einsatz von warmen Bädern, Campherpuder und -salbe nicht besserten. Dr. Macintyre diagnostizierte außerdem Ödeme am Körper von McBean und untersuchte daher den Urin des Patienten. Dieser war dunkel und flockte bei Erhitzung aus („abound in animal matter“). Fast gleichzeitig schickte Watson mit der Frage „What is it?“ eine Urinprobe an den Arzt und Chemiker Bence Jones, welcher Proteine im Urin von McBean – und anderer Patienten mit ähnlichen Beschwerden – feststellte und diese charakterisierte.[56] Der Zustand von McBean verschlechterte sich im Verlaufe des Jahres 1845 rapide, er hatte starke Schmerzen und konnte das Bett nicht mehr verlassen. Am 1. Januar 1846 verstarb McBean schließlich, in seiner Todesurkunde wurde „Atrophie durch Albuminurie“ als Todesursache festgehalten.[55]
Die Obduktion, bei der die Doktoren Macintyre, Watson und Jones anwesend waren, zeigte Knochen, die „leicht mit dem Messer zu schneiden waren und einfach brachen“. Die Rippen zerbröckelten förmlich und enthielten eine blutrote, gelatineartige und ölige Masse. Auch die gesamte Wirbelsäule war von ähnlicher Beschaffenheit. Becken-, Oberarm- und Oberschenkelknochen „widerstanden jedoch jedem Versuch, sie mit der Hand zu brechen“. Herz, Lunge und Leber wurden als weitgehend unauffällig beschrieben.[54] John Dalrymple, Chirurg und Mitglied der mikroskopischen Fachgesellschaft, untersuchte zwei Lendenwirbel und eine Rippe von McBean. Er stellte Löcher im Knochen des Patienten fest, welche mit einer roten, gelartigen Masse gefüllt waren. Diese untersuchte er unter dem Mikroskop und fand große, gleichförmig aussehende runde bis ovale Zellen, teilweise mit mehreren Nuclei. Die nach Zeichnungen von Dalrymple angefertigten Holzschnitte zeigen die noch heute gültigen Kriterien für Myelomzellen.[55]
Literatur
Bearbeiten- M. A. Bärtsch Aktuelle Aspekte bei der Diagnostik und Therapie des Plasmazellmyeloms In: Deutsches Ärzteblatt 2017, 142(11), S. 800-804
- D. Felsenberg Monoklonale Gammopathie unklarer Signifikanz (MGUS) In: Forum Sanitas 2018, 2. Ausgabe, S. 39-41
- K. M. Kortüm Das multiple Myelom In: Der Internist 2013, 54(8), S. 963–977
- Hartmut Goldschmidt: Das Multiple Myelom (Plasmozytom). Diagnose und Therapie. 2. Auflage. Unimed, Bremen 2011, ISBN 978-3-8374-1032-7.
Weblinks
Bearbeiten- Myelom Deutschland e. V.
- AMM-Online, Netzwerk für Myelom-Patienten, Informationsportal mit Patientenforum
- Offizielle Seite der International Myeloma Working Group (englischsprachig)
- Plasmozytom / Multiples Myelom. Antworten. Hilfen. Perspektiven. (PDF; 1,17 MB) Blauer Ratgeber #22 der Deutschen Krebshilfe
- Myelom Kontaktgruppe Schweiz
- Multiples Myelom, Pathologie – Bilddatenbank Pathopic der Universität Basel; PathoPic – Anleitung (PDF; 2,2 MB)
- Multiples Myelom | Eine Krebserkrankung des Knochenmarks – Patientenhandbuch (deutschsprachige Ausgabe) der International Myeloma Foundation
- Multiples Myelom | Eine Krebserkrankung des Knochenmarks – Kurze Zusammenfassung der Krankheit und Therapiemöglichkeiten(deutschsprachige Ausgabe) der International Myeloma Foundation
- Multiples Myelom | Eine Krebserkrankung des Knochenmarks - Freelite® - und Hevylite®-Serum-Assays verstehen(deutschsprachige Ausgabe) der International Myeloma Foundation
- The Myeloma Beacon Englischsprachige Seite mit aktuellen Informationen zum Multiplen Myelom
- Operative Therapienotwendigkeit beim Multiplen Myelom
- wikilite.com - Englischsprachige Informationsseite zum biologischen Hintergrund, Diagnostik, Verlaufskontrolle und Therapie Monoklonaler Gammopathien
Einzelnachweise
Bearbeiten- ↑ Klassifikation nach ICD-Code [http://www.icd-code.de/icd/code/C90.0-.html}
- ↑ O. Landgren et al.: Monoclonal gammopathy of undetermined significance (mgus) consistently precedes multiple myeloma: a prospective study. In: Blood. 113. Jahrgang, Nr. 22, 2009, S. 5412–5417, doi:10.1182/blood-2008-12-194241, PMID 19179464.
- ↑ H. T. Tsai et al.: Evidence of serum immunoglobulin abnormalities up to 9.8 years before diagnosis of chronic lymphocytic leukemia: a prospective study. In: Blood. 114. Jahrgang, Nr. 24, 2009, S. 4928–4932, doi:10.1182/blood-2009-08-237651, PMID 19828698.
- ↑ a b c d e N. van de Donk et al.: The clinical relevance and management of monoclonal gammopathy of undetermined significance and related disorders: recommendations from the European Myeloma Network. In: Haematologica. 99. Jahrgang, Nr. 6, 21. März 2014, S. 984–96, doi:10.3324/haematol.2013.100552, PMID 23224402, PMC 4040895 (freier Volltext).
- ↑ S. V. Rajkumar et al.: Smoldering multiple myeloma. In: Blood. 125. Jahrgang, Nr. 20, 2. April 2015, S. 3069-75, doi:10.1182/blood-2014-09-568899, PMID 25838344, PMC 4432003 (freier Volltext).
- ↑ S. H. Swerdlow, E. Campo, N. L. Harris, E. S. Jaffe, S. A. Pileri, H. Stein, J. Thiele, J. W. Vardiman (Hrsg.): WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4. Auflage. IARC Press, Lyon 2008, ISBN 978-92-832-2431-0 (die WHO-Klassifikation von 2008)
- ↑ a b N Leung et al.: Monoclonal gammopathy of renal significance: when MGUS is no longer undetermined or insignificant. In: Blood. 120. Jahrgang, Nr. 22, 22. November 2012, S. 4292–4295, doi:10.1182/blood-2012-07-445304, PMID 23224402.
- ↑ O. Landgren et al.: Shall we treat smoldering multiple myeloma in the near future? In: Hematology Am Soc Hematol Educ Program. 2017. Jahrgang, Nr. 1, 2017, S. 194–204, doi:10.1182/asheducation-2017.1.194, PMID 29222256.
- ↑ a b WHO Disease and injury country estimates. In: World Health Organization. 2009, archiviert vom am 11. November 2009; abgerufen am 11. November 2009.
- ↑ Bundesamt für Statistik Multiples Myelom PDF, 216 KB, abgerufen am 11. April 2017
- ↑ J. L. Harousseau, P. Moreau: Autologous hematopoietic stem-cell transplantation for multiple myeloma. In: The New England journal of medicine. Band 360, Nummer 25, Juni 2009, S. 2645–2654, ISSN 1533-4406. doi:10.1056/NEJMct0805626. PMID 19535803. (Review).
- ↑ S. C. Bernstein, A. R. Perez-Atayde, H. J. Weinstein: Multiple myeloma in a child. In: Cancer. Band 56, Nummer 8, Oktober 1985, S. 2143–2147, ISSN 0008-543X. PMID 3928137.
- ↑ Fact Sheet der International Agency for Research on Cancer WHO GLOBOCAN 2012
- ↑ a b G. P. Mead et al.: Serum free light chains for monitoring multiple myeloma. In: Br J Hematol. 126. Jahrgang, Nr. 3, 2004, S. 348–354, doi:10.1111/j.1365-2141.2004.05045.x, PMID 15257706.
- ↑ R. A. Kyle et al.: Review of 1027 patients with newly diagnosed multiple myeloma. In: Mayo Clin Proc. 78. Jahrgang, Nr. 1, 2003, S. 21–33, doi:10.4065/78.1.21, PMID 12528874.
- ↑ M. Drayson et al.: Effects of paraprotein heavy and light chain types and free light chain load on survival in myeloma: an analysis of patients receiving conventional-dose chemotherapy in Medical Research Council UK multiple myeloma trials. In: Blood. 108. Jahrgang, Nr. 6, 2006, S. 2013-9, doi:10.1182/blood-2006-03-008953, PMID 16728700.
- ↑ M. M. Dupuis et al.: Non-secretory multiple myeloma: from biology to clinical management. In: Onco Targets Ther. 9. Jahrgang, 2004, S. 7583–7590, doi:10.2147/OTT.S122241, PMID 28008276, PMC 5171196 (freier Volltext).
- ↑ Krebsregister Niedersachsen - Sonderauswertung Gemeinde Bothel 2014 (PDF)
- ↑ Seema Singhal, Jayesh Mehta: Multiple Myeloma. In: Clin J Am Soc Nephrol. 2006, 1, S. 1322–1330.
- ↑ A.M. Rajan et al.: Interpretation of cytogenetic results in multiple myeloma for clinical practice. In: Blood Cancer J. 5. Jahrgang, Nr. 10, 30. Oktober 2015, S. e365, doi:10.1038/bcj.2015.92, PMID 26517360, PMC 4635200 (freier Volltext).
- ↑ S.K. Kumar et al.: Multiple myeloma. In: Nat Rev Dis Primers. 3. Jahrgang, 20. Juli 2017, S. 17046, doi:10.1038/nrdp.2017.46, PMID 28726797.
- ↑ a b c DGHO Leitlinie „Multiples Myelom“. Abgerufen am 25. Juni 2018.
- ↑ Laura M. Dember: Light Chains, Casts, Sheets and Fibrils: Monoclonal Immunoglobulin Diseases and Immunotactoid/Fibrillary Glomerulopathy. In: Clin J Am Soc Nephrol. 2006, 1, S. 1320–1321.
- ↑ T Golombick et al.: Prevalence of monoclonal gammopathy of undetermined significance/myeloma in patients with acute osteoporotic vertebral fractures. In: Acta Haematol. 120. Jahrgang, Nr. 2, 14. Oktober 2008, S. 87–90, doi:10.1159/000162282, PMID 18852483.
- ↑ N Steiner et al.: Are neurological complications of monoclonal gammopathy of undetermined significance underestimated? In: Oncotarget. 8. Jahrgang, Nr. 3, 10. Dezember 2016, S. 5081–5091, doi:10.18632/oncotarget.13861, PMID 27974705, PMC 5354894 (freier Volltext).
- ↑ a b SV Rajkumar et al.: International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. In: Lancet Oncology. 15. Jahrgang, November 2014, S. e538–e548, doi:10.1038/leu.2010.60, PMID 20410922.
- ↑ Erentraud Hömberg: Neues vom Myelom-Weltkongress: Sowohl Diagnostik als auch Therapie entwickeln sich rasant. Medscape, 23. April 2013, abgerufen am 28. Dezember 2015.
- ↑ a b c S. K. Kumar u. a.: Improved survival in multiple myeloma and the impact of novel therapies. In: Blood. Nr. 111(5), März 2008, S. 2516–2520, doi:10.1182/blood-2007-10-116129.
- ↑ B. G. Durie et al.: A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. In: Cancer. 36. Jahrgang, Nr. 3, September 1975, S. 842-54, PMID 1182674.
- ↑ A. Palumbo et al.: Revised International Staging System for Multiple Myeloma: a report from IMWG. In: J Clin Oncol. 33. Jahrgang, Nr. 26, 10. September 2015, S. 2863–2869, doi:10.1200/JCO.2015.61.2267, PMID 26240224, PMC 4846284 (freier Volltext).
- ↑ a b c R. A. Kyle et al.: Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma :IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. In: Leukemia. 24. Jahrgang, 4. Februar 2010, S. 1121–1127, doi:10.1038/leu.2010.60, PMID 20410922.
- ↑ R. S. Go et al.: Determining the clinical significance of monoclonal gammopathy of undetermined significance: a SEER-Medicare population analysis. In: Leukemia. 15. Jahrgang, Nr. 3, 28. September 2014, S. 177–186.e4, doi:10.1016/j.clml.2014.09.004, PMID 25445471, PMC 4344843 (freier Volltext).
- ↑ International Myeloma Working Group (IMWG) Criteria for the Diagnosis of Multiple Myeloma
- ↑ a b M. Gentile u. a.: Emerging biological insights and novel treatment strategies in multiple myeloma. In: Expert Opinion on Emerging Drugs. Nr. 17(3), September 2012, S. 407–438, doi:10.1517/14728214.2012.713345.
- ↑ a b P. Moreau: The Future of Therapy for Relapsed/Refractory Multiple Myeloma: Emerging Agents and Novel Treatment Strategies. In: Seminars in Hematology. Nr. 49(1), Juli 2012, S. 33–46, doi:10.1053/j.seminhematol.2012.05.004.
- ↑ a b Kerstin A. Gräfe: Panobinostat – Neues Wirkprinzip beim Myelom. In: Pharmazeutische Zeitung. 2015, abgerufen am 28. Dezember 2015 (Ausgabe 39/2015).
- ↑ Pomalidomide Celgene: EPAR - Summary for the public Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) (englisch), abgerufen am 28. August 2013.
- ↑ Pomalidomide Celgene: Zusammenfassung des EPAR für die Öffentlichkeit (PDF; 84 kB) EMA - Europäische Arzneimittelagentur (deutsch), abgerufen am 28. August 2013.
- ↑ M. Dimopoulos et al.: Lenalidomide plus Dexamethasone for Relapsed or Refractory Multiple Myeloma. In: N Engl J Med. Nr. 357, 2007, S. 2123–2132 (Abstract).
- ↑ V. Kotla et al.: Mechanism of action of lenalidomide in hematological malignancies. In: J Hematol Oncol. 12. Jahrgang, Nr. 2, 12. August 2009, S. 36, doi:10.1186/1756-8722-2-36, PMID 19674465, PMC 2736171 (freier Volltext).
- ↑ European Commission Approves Kyprolis® (carfilzomib) For Combination Use In The Treatment Of Patients With Relapsed Multiple Myeloma, PM AMGEN vom 19. November 2015, abgerufen am 23. November 2015
- ↑ EMA approves Ninlaro, PM EMA Oktober 2017, abgerufen am 03. Juli 2018
- ↑ Erster Histon-Deacetylase-Hemmer in EU zugelassen. In: Pharmazeutische Zeitung. 14. September 2015, abgerufen am 28. Dezember 2015.
- ↑ H. M. Lokhorst et al.: Targeting CD38 with Daratumumab Monotherapy in Multiple Myeloma. In: The New England Journal of Medicine. 373. Jahrgang, Nr. 13, 24. September 2015, S. 1207–1219, doi:10.1056/NEJMoa1506348, PMID 26308596.
- ↑ http://adisinsight.springer.com/drugs/800022454
- ↑ Empliciti (elotuzumab) for Injection, for Intravenous Use. Full Prescribing Information. In: Empliciti (elotuzumab) for US Healthcare Professionals. Bristol-Myers Squibb Company, archiviert vom am 8. Dezember 2015.
- ↑ a b S. Kumar et al.: International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. In: Lancet Oncol. 17. Jahrgang, Nr. 8, 2016, S. e328-e346, doi:10.1016/s1470-2045(16)30206-6, PMID 27511158.
- ↑ F. E. Davies: Is molecular remission the goal of multiple myeloma therapy? In: Hematology Am Soc Hematol Educ Program. 2017. Jahrgang, Nr. 1, 2017, S. 205–211, doi:10.1182/asheducation-2017.1.205, PMID 29222257.
- ↑ H. Ludwig et al.: Immunoglobulin heavy/light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. In: Leukemia. 27. Jahrgang, Nr. 2, 2013, S. 213–219, doi:10.1038/leu.2012.197, PMID 22955329.
- ↑ M. Michallet et al.: Heavy + light chain monitoring correlates with clinical outcome in multiple myeloma patients. In: Leukemia. 32. Jahrgang, Nr. 2, 2017, S. 376–382, doi:10.1038/leu.2017.209, PMID 28663581.
- ↑ N. C. Munshi: Association of Minimal Residual Disease With Superior Survival Outcomes in Patients With Multiple Myeloma: A Meta-analysis. In: JAMA Oncol. 3. Jahrgang, Nr. 1, 2017, S. 28–35, doi:10.1001/jamaoncol.2016.3160, PMID 27632282.
- ↑ J. Dalrymple: On the microscopical character of mollities ossium. In: Dublin Quarterly Journal of Medical Science. Nr. 2, 1846, S. 85–95.
- ↑ D. Morse, R. C. Dailey, J. Bunn: Prehistoric multiple myeloma. In: Bulletin of the New York Academy of Medicine. Nr. 50, 1974, S. 447–458, PMID 4594853.
- ↑ a b c W Macintyre: Case of mollities and fragilitas ossium, accompanied with urine strongly charged with animal matter. In: Medical and Chirurgical Transactions of London. Nr. 33, 1850, S. 211–232.
- ↑ a b c R. A. Kyle: Multiple myeloma: an odyssey of discovery. In: British Journal of Haematology. Nr. 111(4), 2000, S. 1035–1044, PMID 11167737.
- ↑ H. Bence Jones: On a new substance occurring in the urine of a patient with mollities ossium. In: Philosophical Transactions of the Royal Society of London (Biology). 1848, S. 55–62.
Kategorie:Non-Hodgkin-Lymphom Kategorie:Krankheitsbild in der Nephrologie Kategorie:Krebserkrankung