Ein Protein, umgangssprachlich Eiweiß (veraltet Eiweißstoff) genannt, ist ein biologisches Makromolekül, das aus Aminosäuren aufgebaut wird, die durch Peptidbindungen verknüpft sind.
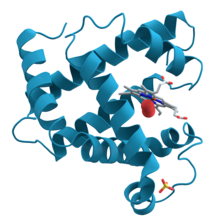
Dieses Globin dient in Muskelzellen als Sauerstoffspeicher. Seine aus über 150 Aminosäuren aufgebaute Peptidkette mit α-Helices faltet sich kugelförmig zur räumlichen Proteinstruktur und hält eine Hämgruppe, an deren Eisenatom sich O2 anlagern kann.
Proteine finden sich in jeder Zelle und machen zumeist mehr als die Hälfte des Trockengewichts aus.[1] Sie dienen ihr als molekulare „Werkzeuge“ und erfüllen je nach der besonderen Struktur unterschiedliche Aufgaben, indem sie beispielsweise Zellbewegungen ermöglichen, Metabolite transportieren, Ionen pumpen, chemische Reaktionen katalysieren oder Signalstoffe erkennen können. Überwiegend aus Proteinen bestehen so auch Muskeln, Herz, Hirn, Haut und Haare.
Die Gesamtheit aller Proteine in einem Lebewesen, einem Gewebe, einer Zelle oder einem Zellkompartiment, unter exakt definierten Bedingungen und zu einem bestimmten Zeitpunkt, wird als Proteom bezeichnet.
Wortherkunft und Geschichte
Das Wort Protein wurde erstmals 1839 in einer Veröffentlichung[2] von Gerardus Johannes Mulder benutzt. Diese Bezeichnung wurde ihm 1838 von Jöns Jakob Berzelius vorgeschlagen, der sie von dem griechischen Wort πρωτεῖος proteios für „grundlegend“ und „vorrangig“, basierend auf πρῶτος protos für „Erster, Vorderster“ oder „Vorrangiger“, abgeleitet hatte. Dahinter stand die irrtümliche Idee, dass alle Proteine auf einer gemeinsamen Grundsubstanz basieren.[3] Daraus entstand ein heftiger Streit mit Justus von Liebig.
Dass Proteine aus Aminosäurenketten über Peptidbindungen aufgebaut sind, wurde zuerst 1902 auf der 14. Versammlung deutscher Naturforscher und Ärzte unabhängig von Emil Fischer und Franz Hofmeister, die beide Vorträge hielten, vermutet. Fischer führte dabei den Begriff Peptid ein.[4]
Proteinbiosynthese
Bausteine der Proteine sind bestimmte als proteinogen, also proteinaufbauend, bezeichnete Aminosäuren, die durch Peptidbindungen zu Ketten verbunden sind. Beim Menschen handelt es sich um 21 verschiedene Aminosäuren – den 20 seit langem bekannten sowie Selenocystein. Auf acht Aminosäuren ist der menschliche Organismus besonders angewiesen, denn sie sind essenziell, was bedeutet, dass der Körper sie nicht selbst herstellen kann, sondern mit der Nahrung aufnehmen muss. Die Aminosäureketten können eine Länge von bis zu mehreren tausend Aminosäuren haben, wobei man Aminosäureketten mit einer Länge von unter ca. 100 Aminosäuren als Peptide bezeichnet und erst ab einer größeren Kettenlänge von Proteinen spricht. Die molekulare Größe eines Proteins wird in der Regel in Kilo-Dalton (kDa) angegeben. Titin, das mit ca. 3600 kDa größte bekannte menschliche Protein, besteht aus über 30.000 Aminosäuren und beinhaltet 320 Proteindomänen.
Die Aminosäurensequenz eines Proteins – und damit sein Aufbau – ist in der Desoxyribonukleinsäure (DNA) codiert. Der dazu verwendete genetische Code hat sich während der Evolution der Lebewesen kaum verändert. In den Ribosomen, der „Proteinproduktionsmaschinerie“ der Zelle, wird diese Information verwendet, um aus einzelnen Aminosäuren eine Polypeptidkette zusammenzusetzen, wobei die je von einem Codon bestimmten Aminosäuren in der von DNA vorgegebenen Reihenfolge verknüpft werden. Erst mit der Faltung dieser Kette im wässrigen Zellmilieu entsteht dann die dreidimensionale Form eines bestimmten Proteinmoleküls.
Das haploide humane Genom enthält rund 20.350 Protein-codierende Gene – viel weniger, als vor der Sequenzierung des Genoms angenommen.[5] Tatsächlich codieren nur etwa 1,5 % der gesamten genomischen DNA für Proteine, während der Rest aus Genen für non-coding RNA, sowie Introns, regulatorischer DNA und nichtcodierenden Desoxyribonukleinsäuren besteht.[6] Da viele der Protein-codierenden Gene – etwa durch alternatives Splicing des Primärtranskripts (Präkursor-mRNA) eines Gens – mehr als ein Protein produzieren, kommen im menschlichen Körper weit mehr als nur 20.350 verschiedene Proteine vor. Darüber hinaus kennt man heute Proteine, deren Bildung auf Exons von Genen oder Gensegmenten in räumlich weit entfernten Chromosomregionen, mitunter sogar unterschiedlichen Chromosomen, zurückgeht.[7] Mithin ist die traditionelle Ein-Gen-ein-Enzym-Hypothese (auch: Ein-Gen-eine mRNA-ein-Protein-Hypothese) für höhere Organismen heute nicht mehr haltbar.[8][9]
Proteinstruktur
Anzahl der beteiligten Aminosäuren
Kleine Peptide werden als Oligopeptide bezeichnet, wobei Dipeptide nur aus zwei Aminosäuren aufgebaut sind, Tripeptide aus drei, Tetrapeptide aus vier Aminosäuren etc. Größere Peptide mit mehr als zehn Aminosäuren werden Polypeptide genannt. Die meisten Proteine sind Ketten von 100 bis 300 Aminosäuren, selten haben sie über tausend (siehe Balkengrafik). Das größte bekannte Protein besteht aus einer Kette von über 30.000 peptidisch verknüpften Aminosäuren und ist in Muskelzellen zu finden: Titin.
Proteine brauchen für ihre Funktion eine gewisse Größe. So können Oligopeptide als Signalstoffe – etwa als Hormon oder als Neurotransmitter – eingesetzt werden, für eine Enzymfunktion sind aber meist mehr als 50 Aminosäuren nötig. Unbegrenzt viele Aminosäuren kann ein Protein schon deshalb nicht enthalten, da nur eine begrenzte Menge Aminosäuren zur Verfügung steht. Zudem hängt die Dauer für den Zusammenbau einer Aminosäurenkette ab von der Anzahl der Aminosäuren (siehe Proteinbiosynthese).
Räumlicher Aufbau
Die räumliche Struktur bedingt die Wirkungsweise der Proteine. Die Proteinstruktur lässt sich auf vier Betrachtungsebenen beschreiben:
- Als Primärstruktur eines Proteins wird die Abfolge (Sequenz) der einzelnen Aminosäuren einer Polypeptidkette bezeichnet. Vereinfacht gesagt, könnte man sich eine Kette vorstellen, in der jedes Kettenglied eine Aminosäure darstellt (Schreibweise vom Amino/N- zum Carboxy/C-Terminus: AS1–AS2–AS3–AS4- …). Die Primärstruktur beschreibt lediglich die Aminosäurensequenz, jedoch nicht den räumlichen Aufbau des Proteins. Hierzu gehört auch die Signalsequenz.
- Als Sekundärstruktur wird die Zusammensetzung des Proteins aus besonders häufig auftretenden Motiven für die räumliche Anordnung der Aminosäuren bezeichnet. Man unterscheidet dabei zwischen folgenden Strukturtypen: α-Helix, β-Faltblatt, β-Schleife, β-Helix und ungeordnete, so genannte Random-Coil-Strukturen. Diese Strukturen ergeben sich durch Wasserstoffbrückenbindungen zwischen den Peptidbindungen des Polypeptid-Rückgrates. Jede Aminosäure in einem Protein hat charakteristische Winkel zwischen den einzelnen Atomen des Rückgrates (Diederwinkel). Den Winkel (N-terminal) vor dem C-Atom mit der Seitenkette einer Aminosäure bezeichnet man als φ-Winkel, den danach als ψ-Winkel. Diese können, mit einer Nummerierung versehen, in einem Ramachandran-Plot gegeneinander aufgetragen werden, um Sekundärstrukturen anzuzeigen. Alternativ kann ein Janin-Plot verwendet werden.
- Die Tertiärstruktur ist die der Sekundärstruktur übergeordnete räumliche Anordnung der Polypeptidkette. Sie wird von den Kräften und Bindungen zwischen den Resten (d. h. den Seitenketten) der Aminosäuren bestimmt. Als Bindungskräfte, die diese dreidimensionale Struktur stabilisieren, wirken beispielsweise Disulfidbrücken, (kovalente Bindungen zwischen den Schwefelatomen zweier Cysteinreste) oder vor allem nicht-kovalente Wechselwirkungen wie die zuvor genannten Wasserstoffbrückenbindungen. Zusätzlich spielen hydrophobe, ionische und Van-der-Waals-Kräfte eine wichtige Rolle. Durch diese Kräfte und Bindungen faltet sich das Protein weiter.
- Viele Proteine müssen sich, um funktionsfähig sein zu können, zu einem Proteinkomplex zusammenlagern, der so genannten Quartärstruktur. Dies kann entweder eine Zusammenlagerung von unterschiedlichen Proteinen sein oder ein Verband aus zwei oder mehr Polypeptidketten, die aus ein und derselben Polypeptidkette, dem Vorläuferprotein (engl. Precursor) hervorgegangen sind (vgl.: Insulin). Als Vorläuferproteine bezeichnet man die Prä- (mit noch zu proteolysierenden Signal- oder Aktivierungssequenzen) und die Präproproteine (mit noch zu proteolysierenden Signal- und Aktivierungssequenzen). Dabei sind die einzelnen Proteine häufig durch Wasserstoffbrücken und Salzbrücken aber auch durch kovalente Bindungen miteinander verknüpft. Die einzelnen Untereinheiten eines solchen Komplexes werden als Protomere bezeichnet. Einige Protomere können ihre Funktion auch als eigenständige Proteine besitzen, aber viele erreichen ihre Funktionalität nur im Komplex. Als Beispiel für aus mehreren Proteinen zusammengelagerte Komplexe können die Immunglobuline (Antikörper) dienen, bei denen jeweils zwei identische schwere und zwei identische leichte Proteine über insgesamt vier Disulfidbrücken zu einem funktionsfähigen Antikörper verbunden sind.
- Einige Proteine ordnen sich noch in einer über die Quartärstruktur hinausgehenden, molekular aber bereits ebenso prädeterminierten „Überstruktur“ oder „Suprastruktur“ an, wie Kollagen in der Kollagenfibrille oder Aktin, Myosin und Titin im Sarkomer.
Die Einteilung in Primär- bis Quartärstruktur erleichtert das Verständnis und die Beschreibung der Faltung von Proteinen. Unter physiologischen Bedingungen faltet eine definierte Primärstruktur zu einer bestimmten Tertiärstruktur auf. Anders gesagt: Der Gehalt an Information, der schon in der Primärstruktur als lineare Aminosäuresequenz enthalten ist, äußert sich in Gestalt einer bestimmten dreidimensional formierten Proteinstruktur.
Für diese Faltung der Polypeptidkette in die charakteristische dreidimensionale Form des nativen Proteins sind aber besondere Umgebungsbedingungen erforderlich – so unter anderem ein wässriges Medium, ein pH-Wert in einem bestimmten engen Bereich, eine Temperatur innerhalb gewisser Grenzen. Sie werden erfüllt im Milieu der Zelle innerhalb deren Membran. Dennoch würden viele komplexe Proteine nicht spontan zu jener Struktur falten, die in der Zelle funktionstragend ist, sondern brauchen dazu Faltungshelfer, sogenannte Chaperone. Die Chaperone binden an neugebildete (naszierende) Polypeptide – oder denaturierte bzw. beschädigte Aminosäureketten – und verhelfen ihnen unter Verbrauch chemischer Energie zur physiologisch funktionellen Struktur.
Klassifizierung von Proteinen
Man kann Proteine nach der äußeren Form in zwei Hauptgruppen einteilen:
- die globulären Proteine, deren Tertiär- oder Quartärstruktur annähernd kugel- oder birnenförmig aussieht und die meist in Wasser oder Salzlösungen gut löslich sind (beispielsweise das Protein des Eiklars, Ov-Albumin genannt),
- die fibrillären Proteine, die eine fadenförmige oder faserige Struktur besitzen, meist unlöslich sind und zu den Stütz- und Gerüstsubstanzen gehören (beispielsweise die Keratine in den Haaren und Fingernägeln, Kollagen, Aktin und Myosin für die Muskelkontraktion).
Weiterhin werden Proteine nach ihrer Zusammensetzung eingeteilt, z. B. bei konjugierten Proteinen. Daneben ist auch eine Einteilung nach der Funktion möglich, z. B. Strukturproteine.
| Molekülform | Nicht-Protein-Anteil | |
|---|---|---|
| Globuläre Proteine | Fibrilläre Proteine | |
| Albumine | Kollagen | Glykoproteine |
| Globuline | Elastin | Nukleoproteine |
| Histone | Keratin | Chromoproteine |
| Protamine | Fibrinogen | Phosphoproteine |
| Prolamine | Myosin | Lipoproteine |
Proteinoberfläche
Vereinfachend wird stellvertretend für die komplexe Proteinstruktur oft nur das Rückgrat (Backbone) des Proteins abgebildet (z. B. Abbildungen rechts oben). Zum Verständnis der Funktion ist jedoch die Oberfläche des Proteins von großer Bedeutung. Da die Seitenketten der Aminosäuren vom Rückgrat aus in den Raum ragen, tragen auch sie entscheidend zur Struktur bei: Der Verlauf des Rückgrats bestimmt den generellen dreidimensionalen Aufbau, aber die Konturen der Oberfläche und die biochemischen Eigenschaften des Proteins werden von den Seitenketten bestimmt.
3D-Darstellung
Zum besseren Verständnis von Aufbau und Funktion ist es unerlässlich, die räumliche Gestalt von Proteinen mithilfe geeigneter Grafikprogramme darzustellen.
Das meistverbreitete Dateiformat für Atompositionsdaten von Proteinen ist das PDB-Format der freizugänglichen Protein Data Bank. Eine PDB-Datei enthält zeilenweise Einträge für jedes Atom im Protein, sortiert nach der Aminosäuresequenz; im einfachsten Fall sind das Atomart und kartesische Koordinaten. Es handelt sich also um ein systemunabhängiges Klartext-Format. Auf Basis dieser Datei kann dann z. B. in Jmol die 3D-Struktur dargestellt werden. Ist die natürliche 3D-Struktur noch nicht ermittelt, hilft nur noch die Proteinstrukturvorhersage.
Proteinchemie
Reinigung
Die Aufreinigung und Anreicherung von Proteinen aus biologischem Material ist ein wichtiger Schritt in der biochemischen Identifikation und Charakterisierung von neu entdeckten Proteinen.
In der Biotechnologie und dort besonders bei rekombinanten Proteinen ist die reproduzierbare, sorgfältige Proteinreinigung – meist in großem Maßstab – eine wichtige Voraussetzung zur Verwendung dieser Proteine in der Diagnostik oder Therapie.
Quantitativer Nachweis
Folgende Nachweise, die keine Absolutmessungen darstellen und alle ihre Limitationen haben (z. B. Fehlmessungen durch interferierende Substanzen; Bezug auf ein bestimmtes Standardprotein etc.), dienen zur Quantifizierung von Proteinen:
- UV-Absorption
- Xanthoproteinreaktion
- Millon-Reaktion
- Ninhydrinreaktion
- Biuretreaktion
- Bradford-Test
- Lowry-Test
- BCA-Test
- Folin-Reagenz
- Aminosäureanalyse
Identifikation
Der Nachweis der Identität eines Proteins kann über vielfältige Methoden erfolgen. Auch kann ein indirekter Nachweis über andere Eigenschaften als die Primärstruktur erfolgen, welche jedoch aus ihr folgen, z. B. über die Anwesenheit seiner Funktion (Enzymkinetik) im Probengefäß oder über immunologische Eigenschaften, die unter anderem in einem Western Blot verwendet werden.
Denaturierung
Sowohl durch chemische Einflüsse, wie zum Beispiel Säuren, Salze oder organische Lösungsmittel, als auch durch physikalische Einwirkungen, wie hohe oder tiefe Temperaturen oder auch Druck, können sich die Sekundär- und Tertiärstruktur und damit auch die Quartärstruktur von Proteinen ändern, ohne dass sich die Reihenfolge der Aminosäuren (Primärstruktur) ändert. Dieser Vorgang heißt Denaturierung und ist in der Regel nicht umkehrbar, das heißt, der ursprüngliche dreidimensionale räumliche Aufbau kann ohne Hilfe nicht wiederhergestellt werden. Bekanntestes Beispiel dafür ist das Eiklar im Hühnerei, das beim Kochen fest wird, weil sich der räumliche Aufbau der Proteinmoleküle geändert hat. Der ursprüngliche flüssige Zustand kann nicht mehr hergestellt werden.
Das Wiederherstellen des ursprünglichen Zustandes des denaturierten Proteins heißt Renaturieren.
Mit der Kontrolle über das Feuer wurde Menschen auch das Kochen möglich, womit nicht zuletzt Speisen bekömmlicher und leicht verdaulich zubereitet werden können. Durch Denaturierung beim Erhitzen ändern sich die physikalischen und physiologischen Eigenschaften von Proteinen, etwa beim Spiegelei, das durch die Hitze in der Pfanne verändert wird. Auch sehr hohes Fieber kann oberhalb einer gewissen Temperatur körpereigene Proteine denaturieren. Diese Proteine können ihre Aufgaben im Organismus dann nicht mehr erfüllen, was für den Menschen lebensgefährlich werden kann.
Einige Proteine der roten Blutkörperchen denaturieren beispielsweise bereits bei 42 °C. Der geregelte Fieberanstieg bleibt daher unterhalb solcher Temperaturen. Die Erhöhung der Körpertemperatur beim Fieber bedeutet eine Beschleunigung der Stoffwechselprozesse (siehe RGT-Regel) und erlaubt damit dem Abwehrsystem raschere Reaktionen. Dieses Fieber wird vom Körper selber erzeugt (siehe Pyrogen), um sich besser gegen eingedrungene Erreger oder Fremdkörper (siehe auch Antigen) wehren zu können. Viele der körperfremden Proteine denaturieren schon bei geringeren Temperaturen als die körpereigenen.
Hydrolyse und Oxidation
Die durch hydrolytische Spaltung der Proteinketten (Proteolyse) entstehenden Teilstücke sind ein Gemisch aus Peptiden und Aminosäuren; sind diese unter katalytischer Wirkung von Pepsin entstanden, nennt man sie Pepton, im Falle von Trypsin Trypton.
Durch reaktive Sauerstoffspezies können Proteine oxidiert werden. Dieser Vorgang heißt Proteinoxidation und spielt bei der Alterung und einer Reihe von pathologischen Prozessen eine wichtige Rolle. Die Oxidation kann einen weitgehenden Funktionsverlust bedeuten und zur Ansammlung von degenerierten Proteinen in der Zelle führen.[10]
Biologische Funktionen
Proteine können im Organismus folgende, sehr spezielle Funktionen haben:
- Schutz, Verteidigung gegen Mikroorganismen
- Antikörper (extern und intern) dienen zur Abwehr von Infektionen.
- Beutefang
- Toxine führen zur Lähmung von Beutetieren, z. B. bei Schlangen, bei Skorpionen und (durch Conotoxine) bei Kegelschnecken.
- Körperstruktur, Bewegung
- Kollagene, die bis zu 1/3 des gesamten Körperproteins ausmachen können, sind Strukturproteine der Haut, des Bindegewebes und der Knochen. Als Strukturproteine bestimmen sie den Aufbau der Zelle und damit letztlich die Beschaffenheit der Gewebe und des gesamten Körperbaus.
- In den Muskeln verändern Myosine und Aktine ihre Form und sorgen dadurch für Muskelkontraktion und damit für Bewegung.
- Keratinstrukturen wie Haare/Wolle, Hörner, Nägel/Klauen, Schnäbel, Schuppen und Federn
- Seidenfäden bei Spinnen und Insekten
- Stoffumsatz (hier Proteinmetabolismus[11]), Transport, Signalfunktion
- Enzyme übernehmen Biokatalysefunktionen, d. h., sie ermöglichen und kontrollieren sehr spezifische (bio)chemische Reaktionen in Lebewesen.
- Als Ionenkanäle regulieren Proteine die Ionenkonzentration in der Zelle, und damit deren osmotische Homöostase sowie die Erregbarkeit von Nerven und Muskeln.
- Als Transportproteine übernehmen sie den Transport körperwichtiger Substanzen wie z. B. Hämoglobin, das im Blut für den Sauerstofftransport zuständig ist, oder Transferrin, das Eisen im Blut transportiert.
- In Zellmembranen befinden sich Membranrezeptoren; meist Komplexe aus mehreren Proteinen (auch Multiproteinkomplexe genannt), die Substanzen außerhalb der Zelle erkennen und binden. Dadurch ergibt sich eine Konformationsänderung, die dann als Transmembransignal im Innern der Zelle erkannt wird.
- Adapterproteine verbinden vorübergehend mehrere andere Proteine, wodurch eine Signaltransduktion entstehen kann
- Manche (meist kleinere Proteine) steuern als Hormone Vorgänge im Körper.
- Als Blutgerinnungsfaktoren verhindern die Proteine einerseits einen zu starken Blutverlust bei einer Verletzung eines Blutgefäßes und andererseits eine zu starke Gerinnungsreaktion mit Blockierung des Gefäßes.
- Auto-fluoreszierende Proteine in Quallen.
- Reservestoff
- Als Reservestoff kann der Körper Proteine im Hungerzustand als Energielieferanten verwenden. Dabei können die in Leber, Milz und Muskeln gespeicherten Proteine nach Proteolyse und Abbau der entstehenden Aminosäuren zu Pyruvat entweder zur Glukoneogenese oder direkt zur Energiegewinnung genutzt werden.
Mutationen in einem bestimmten Gen können potentiell Veränderungen im Aufbau des entsprechenden Proteins verursachen, woraus sich folgende mögliche Auswirkungen auf die Funktion ergeben:
- Die Mutation bewirkt einen Verlust in der Proteinfunktion; solche Fehler mit teils vollständigem Wegfall der Proteinaktivität liegen vielen erblichen Krankheiten zugrunde.
- Die Mutation bewirkt bei einem Enzym die Erhöhung der Enzymaktivität. Dies kann vorteilhafte Wirkung haben oder ebenfalls zu einer Erbkrankheit führen.
- Trotz der Mutation bleibt die Funktion des Proteins erhalten. Dies wird als stille Mutation bezeichnet.
- Die Mutation bewirkt eine funktionelle Veränderung, die vorteilhaft für die Zelle, das Organ oder den Organismus ist. Ein Beispiel wäre ein Transmembranprotein, das vor der Mutation nur in der Lage ist, den stoffwechselbaren Metaboliten A aufzunehmen, während nach der Mutation auch der Metabolit B regulierbar aufgenommen werden kann und sich dadurch z. B. die Nahrungsmittelvielfalt erhöht.
Protein in der Nahrung
Proteinbedarf
Proteine erfüllen im menschlichen Körper zahlreiche Aufgaben und sind für alle Organfunktionen von Bedeutung, insbesondere bei der Heilung von Wunden und Krankheiten. Zum Aufbau, zum Erhalt und zur Erneuerung der Körperzellen brauchen Menschen eine Nahrung, die Protein enthält. Bezogen auf das Körpergewicht (KG) ist der Bedarf in den Wachstumsphasen zu Lebensbeginn am höchsten.
Im ersten Lebensmonat sollte der Säugling täglich eine Proteinmenge von etwa 2,5 Gramm pro Kilogramm Körpergewicht (g/kg KG) aufnehmen, gegen Ende des ersten Lebensjahrs genügen etwa 1,3 g/kg KG.[12] Ab dem zweiten Lebensjahr empfiehlt die Deutsche Gesellschaft für Ernährung für die tägliche Aufnahme von Protein mit der Nahrung lebensaltersabhängige Referenzwerte zwischen 1,0 und 0,8 g/kg. Bei Kleinkindern (1,0) ist der Bedarf höher als bei älteren Kindern und Jugendlichen (0,9), bei jüngeren Erwachsene (0,8) niedriger als bei über 65 Jahre alten (geschätzt 1,0) – jeweils bezogen auf das Normalgewicht, nicht das tatsächliche Körpergewicht. Übergewichtige brauchen nicht mehr als normalgewichtige Menschen. Dagegen ist bei schwangeren Frauen der Bedarf um circa 20 % erhöht (1,0), bei stillenden liegt er noch höher (1,2).[12] Es gibt jedoch eine Übersichtsarbeit von 2010, die auch in einem Bericht einer Expertenkommission der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (2013) Beachtung fand,[13] welche den Tagesproteinbedarf für durchschnittliche Erwachsene mit 0,91–1,2 g/kg KG deutlich höher einschätzt.[14] Bei körperlicher Aktivität steigt der Bedarf an Protein laut DGE nicht an.[15] Eine Nierenschädigung aufgrund erhöhten Eiweißkonsums wurde mehrmals in Langzeitstudien widerlegt.[16]
Das mit der Nahrung aufgenommene Protein wird in Magen und Darm verdaut, in kleinere Bestandteile zerlegt und in Bausteine aufgespalten. Zellen der Darmschleimhaut resorbieren diese und geben die einzelnen Aminosäuren in die (portale) Blutbahn ab, die zur Leber führt. Der menschliche Organismus kann einige der Aminosäuren nicht selber herstellen, braucht sie aber als Baustein seiner eigenen Proteine. Mit der Nahrung zugeführtes Protein muss also hinreichen, den Bedarf für jede dieser unentbehrlichen (essenziellen) Aminosäuren abzudecken.
Proteinmangel
Ein Mangel an Protein kann eine Reihe von Symptomen hervorrufen. Andauernder Eiweißmangel führt zu Marasmus, Kwashiorkor oder zu beidem und letzten Endes zum Tod.
- Die Eiweißmangelkrankheit Kwashiorkor tritt vorwiegend in sogenannten Entwicklungsländern auf und betrifft meist unterernährte Kinder, deren fortgeschrittenes Leiden an einem Hungerbauch zu erkennen ist, hervorgerufen durch Einlagerung von Wasser. Wegen der fehlenden Bluteiweiße wie Albumin kommt es auch in anderen Körperregionen zu Ödemen (Hungerödemen). Weitere Symptome sind u. a.
Zu einem Eiweißmangel kommt es in den Industrieländern allerdings sehr selten und nur bei extrem proteinarmen Ernährungsformen. Die durchschnittliche deutsche Mischkost enthält mit 100 Gramm Eiweiß pro Tag mehr als genug Protein. Obgleich in der Werbung Eiweißpulver als für Breitensportler empfehlenswert angepriesen werden, deckt „unsere übliche Ernährung […] auch den Eiweißbedarf von Sportlern ab“, wie es dazu in einem Bericht des Ministeriums für Ernährung und Ländlichen Raum Baden-Württembergs heißt.[17]
Proteinquellen
Sehr proteinhaltige Nahrungsmittel (in alphabetischer Reihenfolge) sind:
- Eier
- Fisch
- Fleisch
- Hülsenfrüchte (Soja und Lupinen ca. 40 %, Bohnen und Erbsen ca. 20 %)
- Milchprodukte (Käse und Quark)
- Nüsse
- Raps (ca. 40 % im Samen; das aus Raps gewonnene Speiseöl einhält kein Protein)
Eine weitere Proteinquelle ist die Quinoa-Pflanze, welche neben ihrem hohen Eiweiß-Gehalt (etwa 14 g auf 100 g) alle 9 essentiellen Aminosäuren enthält.[18] Ihrer Bedeutung als Nahrungsquelle bewusst, erklärte der ehemalige UN-Generalsekretär Ban Ki-moon das Jahr 2013 zum Jahr der Quinoa, da sie besonders in der Zeit des Klimawandels als wichtige Nahrungsquelle dienen und den Hunger in den Entwicklungsländern bekämpfen soll.
Gesundheitliche Aspekte
Stand bislang vor allem die Menge von Proteinen im Vordergrund, so rückt zunehmend die Quelle von Proteinen und deren gesundheitliche Wirkung in den Blick der Forschung.[19] Heute wird aus gesundheitlicher Sicht zum vermehrten Konsum pflanzlicher Proteinquellen geraten.[20] So zeigt eine Studie aus dem Jahr 2016, dass der Konsum von pflanzlichen Proteinquellen zu einer geringeren Mortalität führte, während tierisches Eiweiß zu einer erhöhten Mortalität aufgrund von Herzkreislauferkrankungen führte.[21] Eine Studie aus dem Jahr 2021 bestätigt dieses Ergebnis. In ihr waren pflanzliche Eiweißquellen sowohl mit einer geringeren Gesamtmortalität verbunden als auch mit einer geringeren Mortalität aufgrund von Demenz und Herzkreislauferkrankungen. Tierisches Eiweiß wie verarbeitetes rotes Fleisch und Eier waren hingegen mit einer höheren Gesamtmortalität verbunden.[22] Eine Studie aus 2023 sieht zwar ein geringeres Risiko für Herzkreislauferkrankungen bei Bevorzugung von pflanzlichem Eiweiß, ordnet die Evidenz dafür jedoch als gering ein.[23] Allerdings trägt der Wechsel von tierischen zu pflanzlichen Proteinquellen auch zur Reduktion von CO2-Emissionen und der möglichen Verringerung von Folgen der globalen Erwärmung bei (Siehe auch: Planetare Gesundheit).[24][25]
Wertigkeit von Proteinen
Der Protein Digestibility Corrected Amino Acid Score (PDCAAS) wird von der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO/WHO) und der US Food and Drug Administration als „die beste Methode“ zur Bestimmung der Proteinqualität angenommen.[26][27] Die Kennzahl berücksichtigt sowohl die Aminosäurenzusammensetzung als auch die Verdaulichkeit dieser. Besondere Bedeutung kommt hierbei dem Gehalt an essentiellen Aminosäuren zu. Darüber hinaus gibt es das ältere und mittlerweile überholte Konzept der biologischen Wertigkeit. 2013 hat die FAO außerdem den Digestible Indispensable Amino Acid Score (DIAAS) als Bewertungsmethode zur Bestimmung der Proteinqualität ins Spiel gebracht.[28][29][30] Hauptunterschied ist, dass beim DIAAS die echte ileale Verdaulichkeit gemessen wird. Der DIAAS wird grundsätzlich nicht gekürzt und kann auch Werte über 100 % annehmen. Nur bei der Betrachtung der gesamten Proteinzufuhr, unabhängig davon, ob es sich um eine Mischkost oder um ein einzelnes Nahrungsmittel, wie beispielsweise Säuglingsnahrung, handelt, muss der DIAAS auf 100 % gekürzt werden.[31]
Insgesamt bleibt eine Bewertung von verschiedenen Proteinquellen schwierig, wenn es um dem Erhalt normaler Körperfunktionen geht. So schreibt die Encyclopedia of Human Nutrition:
„Der metabolische Bedarf für die Erhaltung normaler Körperfunktionen und -zusammensetzung ist ein wenig verstandener Vorgang von Aminosäuren, die in vielen weiteren metabolischen Vorgängen zum Einsatz kommen, welche nichts mit der Proteinsynthese zu tun haben und welche jedenfalls völlig unterschiedlich von Wachstumsvorgängen (bspw. den Aminosäurevorgängen in Gewebe) sind und als solche einen weit geringeren Proteinbedarf haben. Daher ist es sehr schwierig den Unterschied von tierischem und pflanzlichen Proteinquellen zu demonstrieren und dieser ist vermutlich weniger bedeutend für die menschliche Ernährung. Derzeit herrscht beträchtliche Uneinigkeit über die nötige Höhe an essenziellen Aminosäuren in der menschlichen Ernährung und es gibt unterschiedlichste Ansichten über die relative Bedeutung der Proteinqualität in der Ernährungswissenschaft.“
Wirtschaftliche Bedeutung
Die Gesamtmenge der als nachwachsende Rohstoffe in der stofflichen Nutzung verwendeten Proteine wird für Deutschland im Regelfall mit etwa 55.000 t pro Jahr angegeben.[33] Genaue Angaben über die Herkunft dieser Proteine gibt es nicht, es ist jedoch anzunehmen, dass sie zu einem großen Teil tierischer Herkunft sind.
Der Großteil pflanzlicher Proteine wird für die Futtermittelindustrie aufgewendet, so die als Nebenprodukte bei der Pflanzenölpressung und -extraktion anfallenden Pressrückstände (z. B. Raps- und Sojakuchen, Extraktionsschrot) und Nebenprodukte der Gewinnung von Stärke aus Getreide. Pflanzen, die zur Hauptnutzung als Proteinpflanzen angebaut werden, wie bspw. Lupine, Eiweißerbse und Ackerbohne, haben nur eine geringe Bedeutung[34] – die Gesamtfläche für den Anbau dieser Pflanzen als nachwachsende Rohstoffe in Deutschland liegt bei etwa 30 ha pro Jahr.[35] Etwa 1.000 t Weizenproteine werden jährlich in der chemischen Industrie eingesetzt.
Von zentraler Bedeutung für die chemisch-technische und biotechnologische Industrie sind dagegen tierische Proteine. Dabei spielt vor allem die Gelatine eine zentrale Rolle, die in Europa vor allem aus Rinderspalt, Schweineschwarten sowie Knochen von Rindern und Schweinen gewonnen wird. In Deutschland werden jährlich etwa 32.000 t Gelatine in Speisequalität hergestellt, die europäische Gesamtproduktion beträgt 120.000 t (70 % Schweineschwarten, 18 % Knochen, 10 % Rinderspalt, 2 % Sonstige).[36][37] Verwendet werden in Deutschland etwa 90.000 t, wobei 2/3 im Ernährungsbereich und von dem Rest etwa die Hälfte für den Futtermittelbereich aufgewendet werden. Etwa 15.000 t werden in der chemischen und pharmazeutischen Industrie verwendet. Dabei finden sich die Haupteinsatzbereiche in der Pharmaindustrie, mit Umhüllungen von Tabletten und Vitaminpräparaten (Hart- und Weichkapseln) sowie Gelatinezäpfchen. Außerdem wird Gelatine für blutstillende Schwämmchen sowie als Blutplasmaersatz eingesetzt. In der analogen Fotografie stellt Gelatine die Basis für die fotoempfindlichen Schichten auf dem Film und dem Fotopapier dar. Auch moderne Druckerpapiere zum Ausdrucken von Farbbildern sind mit Gelatine beschichtet.[37]
Neben Gelatine stellt Casein eine wichtige Proteinquelle für die chemische Industrie dar. Das aus Milcheiweiß gewonnene Protein wird vor allem als Beschichtungsmaterial für Glanzpapiere sowie als Zusatz für Streichfarben verwendet (ca. 1–2 % je nach Hersteller). Zudem findet es Verwendung als Etikettenkleber auf Glasflaschen. Jährlich werden in Deutschland etwa 8.000 bis 10.000 t Casein eingesetzt.
Die Nutzung von Proteinen aus Blutmehl zur Herstellung von bio-basierten Kunststoffen (z. B. Pflanztöpfe) befindet sich noch in der Entwicklung, ebenso ein Verfahren zur biotechnologischen Herstellung von Fasern aus Seidenproteinen zur Verarbeitung in Schäumen, Vliesstoffen oder Folien.[38][39][40]
Etwa 6.000 bis 7.000 t Proteine sind Autolyseprodukte aus Hefen (Hefeextrakte). Diese finden Anwendung vor allem in der Pharmazeutischen Industrie und der Nahrungsmittelindustrie sowie in der Biotechnologischen Industrie als Nährlösung für Mikroorganismen.
Gewinnung von pflanzlichen Proteinen
Pflanzliche Proteine können aus Soja, Erbsen, Lupinen, Raps oder anderen proteinreichen Früchten wie z. B. Sonnenblumenkernen u. a. m. gewonnen werden. Die geernteten proteinhaltigen Früchte werden mechanisch zerkleinert und entfettet. Es entstehen Flocken oder ein proteinreiches Pulver. Anschließend wird unter Verwendung von Lösungsmitteln ein Proteinkonzentrat gewonnen, das ggf. weiter zu Proteinisolat gereinigt und aufkonzentriert wird: Die Flocken oder Mehl werden mit Wasser versetzt und angemaischt. Die proteinarmen Fasern und Feststoffe werden im nächsten Schritt mit Hilfe von Industriezentrifugen von der proteinreichen Lösung abgetrennt. Dann folgt die sogenannte Ausfällung. Hier wird der pH-Wert der proteinreichen Lösung auf den isoelektrischen Punkt eingestellt. Dadurch setzen sich die Proteinpartikel ab. Diese werden dann wiederum mittels Zentrifugen von der Lauge abgetrennt. Um alle Bestandteile der Mutterlauge aus dem ausgefällten und abgetrennten Protein zu entfernen, wird das Protein erneut mit Wasser versetzt und wieder mit Hilfe der Zentrifugalkraft abgetrennt.[41][42]
Bei einer Trockenextrusion wird unter Zuführung von Wärme, Druck und Hilfsstoffen ein Zwischenprodukt mit niedrigem Wassergehalt erzeugt. Es wird in der Fachsprache als TVP (Texturized Vegetable Protein) bezeichnet und hat eine trockene Konsistenz in Form von Körnern, Streifen oder Flocken. Dies kann durch Zugabe von Wasser zu einem schwammartigen Vorprodukt für Fleischersatzprodukte weiter verarbeitet werden. Bei einer Nassextrusion wird alternativ mit einem höheren Wassergehalt operiert. Die Feuchtigkeit des Zwischenproduktes liegt daher näher am Wassergehalt des Endproduktes. Das Zwischenprodukt wird als HMMA (High Moistured Meat Analogues) bezeichnet.
Industrielle Nutzung neuer Proteinquellen
Als vollwertigen Ersatz des proteinreichen Fischmehls durch Protein aus Fliegenlarvenmehl züchtet ein Unternehmen auf dem agrarwissenschaftlichen Gelände der Universität Stellenbosch in Elsenburg (Südafrika) millionenfach Stubenfliegen (Musca domestica) heran. Aus einem Kilogramm Fliegeneier können in nur 72 Stunden ungefähr 380 bis 420 Kilogramm Protein entstehen.
Bei entsprechender Großproduktion könnte ein großer Teil der weltweiten Fischmehlproduktion eingespart und die Weltmeere vom industriellen Fischfang entlastet werden. Noch 2012 will das Unternehmen „Agriprotein“ in die Massenherstellung gehen.[43] Täglich werden 65 t Blut aus herkömmlichen Schlachtereien benötigt, um 100 t Fliegenlarven innerhalb eines Zeitraumes von ca. 3 Tagen auf eine Länge von jeweils rund 12 mm heranzuziehen. Im Wege der Trocknung, Vermahlung zu Madenmehl und anschließenden Pelletierung können so täglich 20 t des Proteinprodukts gewonnen werden.[44] Eine weitere Pilotanlage in Deutschland wird von der deutschen Regierung mit 50 % gefördert.[44] Das Unternehmen hat 2012 den People and Environment Achievement Award erhalten.[43][45][46][47][48]
Herstellung und Optimierung rekombinanter Proteine
Die Herstellung rekombinanter Proteine mit genau festgelegter Aminosäuresequenz und möglicherweise weiteren Veränderungen (z. B. eine Glykosylierung) geschieht sowohl im Labor als auch großtechnisch entweder durch Peptidsynthese oder biotechnologisch durch Überexpression in verschiedenen Organismen und folgender Proteinreinigung.
Im Zuge des Protein-Engineerings können Eigenschaften des gewünschten Proteins gezielt (über das Proteindesign) oder zufällig (über eine gerichtete Evolution) verändert werden. Prinzipiell können industriell dieselben Verfahren angewandt werden wie im Labor, jedoch ist die Verwendung von Nutzpflanzen durch Pharming am besten für die großtechnische Nutzung geeignet, bei der mit Bioreaktoren in Reinräumen gearbeitet wird. Um die geeigneten Organismen zu erhalten, werden gentechnische Methoden eingesetzt.
Die technische Produktion nativer Proteine findet weltweit hauptsächlich in der Pharmazie (Biopharmazeutika) und zur industriellen Verwendung von Enzymen als Waschmittelzusätze (Proteasen, Lipasen, Amylasen und Cellulasen) oder in der Milchverarbeitung (Lactasen) statt. Proteine für die Nahrungsmittelindustrie müssen nicht notwendigerweise in nativer Form hergestellt werden, da eine biologische Aktivität nicht immer erforderlich ist, z. B. bei Käse oder Tofu.
Bedeutung für die Archäologie
Insbesondere mit Hilfe verbesserter Methoden der Massenspektrometrie ist es heute möglich, Proteine oder Teile von Proteinen aus archäologischen und paläontologischen Funden zu analysieren. Aus der Rekonstruktion „fossiler“ Proteine kann zudem auf die sie codierenden Gene und damit auf den Bau der aDNA zurückgeschlossen werden.[49]
Trivia
„Seidenglanz-Proteine“, die als Zusatz für Haarwaschmittel für Menschen und zur Fellpflege für Tiere beworben werden (um vorgeblich Glanz zu erzeugen), werden aus den Resten von Puppen der Seidenraupen, nach Ablösung der diese umhüllenden Seidenfäden, hergestellt.
Im Februar 2020 berichteten Wissenschaftler den Fund eines Protein „Hemolithin“ im Inneren des 1990 gefundenen Meteoriten „Acfer 086“. Proteine sind essentielle Bauteile für die Entstehung von Leben. Falls ihre kontroverse Studie im Peer-Review bestätigt wird, könnte dies die Panspermie-Hypothese stützen. Das Protein könnte in protoplanetarem oder interstellarem Gas entstanden sein.[50][51][52]
Siehe auch
Literatur
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto jr., Lubert Stryer: Stryer Biochemie. 8. Auflage. Springer Spektrum, Berlin/Heidelberg 2018, ISBN 978-3-662-54619-2, doi:10.1007/978-3-662-54620-8.
- Friedrich Lottspeich, Joachim W. Engels (Hrsg.): Bioanalytik. 3. Auflage. Springer Spektrum, Berlin/Heidelberg 2012, ISBN 978-3-8274-2942-1.
- Hubert Rehm, Thomas Letzel: Der Experimentator: Proteinbiochemie / Proteomics. 6. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2312-2.
- E. Buxbaum: Fundamentals of Protein Structure and Function. Springer, New York 2007, ISBN 978-0-387-26352-6 (englisch).
- P. Kaumaya: Protein Engineering. Intech Open, 2012, ISBN 978-953-51-0037-9, doi:10.5772/1286.
Weblinks
- Peptide, Polypeptide (Proteine)
- Protein Database (Aminosäurensequenzen, 3D-Strukturen …)
- Human Protein Atlas – der Atlas enthält über 1 Million von Pathologen zertifizierte Abbildungen und gibt Auskunft über die Lokalisation und Expression von Proteinen in humanem Normal- und Tumorgewebe
- Proteopedia – Proteopedia ist eine interaktive 3D-Enzyklopädie über Proteine und andere Biomoleküle im Wikipedia-Format (englisch)
- UniProt enthält Aminosäuresequenzen von und selektive Informationen zu natürlich vorkommenden Proteinen
Einzelnachweise
- ↑ Neil A. Campbell: Biologie. Hrsg.: Jürgen Markl. 1., korrigierter Nachdruck Auflage. Spektrum, Heidelberg/Berlin/Oxford 1998, ISBN 3-8274-0032-5, S. 80 (englisch: Biology. 1996.).
- ↑ G. J. Mulder: Ueber die Zusammensetzung einiger thierischer Substanzen. In: Journal für praktische Chemie. Band 16, 1839, S. 129–152 (hdl:2027/osu.32435060197092).
- ↑ Duden – Deutsches Universalwörterbuch. 4. Auflage. Mannheim 2001.
- ↑ Theodor Wieland: History of Peptide Chemistry, in: Bernd Gutte (Hrsg.), Peptides, Academic Press 1995, S. 2
- ↑ International Human Genome Sequencing Consortium: Finishing the euchromatic sequence of the human genome. In: Nature. Band 431, Nr. 7011, 2004, S. 931–945, doi:10.1038/nature03001, PMID 15496913.
- ↑ International Human Genome Sequencing Consortium: Initial sequencing and analysis of the human genome. In: Nature. Band 409, Nr. 6822, 2001, S. 860–921, doi:10.1038/35057062, PMID 11237011.
- ↑ P. Kapranov u. a.: Examples of the complex architecture of the human transcriptome revealed by RACE and high-density tiling arrays. In: Genome Research. Band 15, Nr. 7, 2005, S. 987–997, PMID 15998911.
- ↑ J. L. Rupert: Genomics and environmental hypoxia: what (and how) we can learn from the transcriptome. In: High Alt Med Biol. Band 9, Nr. 2, 2008, S. 115–122, PMID 18578642.
- ↑ E. Pennisi: Genomics. DNA study forces rethink of what it means to be a gene. In: Science. Band 15, Nr. 316, 2007, S. 1556–1557, PMID 17569836.
- ↑ E. R. Stadtman, R. L. Levine: Chemical modification of proteins by reactive oxygen species. In: I. Dalle-Donne, A. Scaloni, A. Butterfield (Hrsg.): Redox Proteomics: From Protein Modifications To Cellular Dysfunction And Diseases. (= Wiley-Interscience Series on Mass Spectrometry). 2006, ISBN 0-471-72345-2.
- ↑ Vgl. etwa H. N. Munro, J. B. Allison (Hrsg.): Mammalian protein metabolism. Academic Press, New York 1964.
- ↑ a b DGE: Referenzwerte Protein, abgerufen am 7. Oktober 2017.
- ↑ Dietary protein quality evaluation in human nutrition. Report of an FAQ Expert Consultation. (PDF; 450 kB) In: FAO (Hrsg.): FAO food and nutrition paper. Band 92, Rom 2013, S. 1–66, PMID 26369006, ISBN 978-92-5-107417-6.
- ↑ R. Elango, M. A. Humayun, R. O. Ball, P. B. Pencharz: Evidence that protein requirements have been significantly underestimated. In: Current opinion in clinical nutrition and metabolic care. Band 13, Nummer 1, Januar 2010, S. 52–57, doi:10.1097/MCO.0b013e328332f9b7, PMID 19841581 (Review).
- ↑ Reference Values for Nutrient Intake. ( vom 15. September 2009 im Internet Archive; PDF) Deutsche Gesellschaft für Ernährung, Umschau/Braus, Frankfurt am Main 2000, ISBN 3-8295-7114-3, S. 31.
- ↑ Can eating too much protein be bad for you? 26. August 2019, abgerufen am 29. Januar 2020 (englisch).
- ↑ zit. nach Cornelia Pfaff: Sporternährung: Was ist dran an Eiweißpulver, L-Carnitin und Co? 19. Oktober 2002, abgerufen am 9. Dezember 2019.
- ↑ Vegane Protein-Quellen in Lebensmitteln. 5. Oktober 2017, abgerufen am 19. Januar 2018.
- ↑ Sun Yangbo, Liu Buyun, Snetselaar Linda G., Wallace Robert B., Shadyab Aladdin H.: Association of Major Dietary Protein Sources With All-Cause and Cause-Specific Mortality: Prospective Cohort Study. In: Journal of the American Heart Association. S. e015553, doi:10.1161/JAHA.119.015553 (ahajournals.org [abgerufen am 28. Februar 2021]).
- ↑ Harvard T.H. Chang School of Public Health: Protein. 18. September 2012, abgerufen am 28. Februar 2021 (amerikanisches Englisch).
- ↑ Mingyang Song, Teresa T. Fung, Frank B. Hu, Walter C. Willett, Valter D. Longo: Association of Animal and Plant Protein Intake With All-Cause and Cause-Specific Mortality. In: JAMA Internal Medicine. Band 176, Nr. 10, 1. Oktober 2016, ISSN 2168-6106, S. 1453, doi:10.1001/jamainternmed.2016.4182 (jamanetwork.com [abgerufen am 28. Februar 2021]).
- ↑ Yangbo Sun, Buyun Liu, Linda G. Snetselaar, Robert B. Wallace, Aladdin H. Shadyab: Association of Major Dietary Protein Sources With All-Cause and Cause-Specific Mortality: Prospective Cohort Study. In: Journal of the American Heart Association. S. e015553, doi:10.1161/JAHA.119.015553 (ahajournals.org [abgerufen am 28. Februar 2021]).
- ↑ Christel Lamberg-Allardt, Linnea Bärebring, Erik Kristoffer Arnesen, Bright I. Nwaru, Birna Thorisdottir, Alfons Ramel, Fredrik Söderlund, Jutta Dierkes, Agneta Åkesson: Animal versus plant-based protein and risk of cardiovascular disease and type 2 diabetes: a systematic review of randomized controlled trials and prospective cohort studies. In: Food & Nutrition Research. Band 67, 2023, ISSN 1654-661X, doi:10.29219/fnr.v67.9003, PMID 37050925.
- ↑ What the Alternative Protein Industry Can Learn from EV Companies. In: Boston Consulting Group. 3. Juli 2024, abgerufen am 18. Juli 2024 (englisch).
- ↑ Liam Pritchett: A 50% Market Share For Alt Proteins Could Reduce GHGs More Than EVs, Says Report. In: Plant Based News. 15. Juli 2024, abgerufen am 18. Juli 2024 (britisches Englisch).
- ↑ Protein and amino acid requirements in human nutrition. Report of a joint FAO/WHO/UNU expert consultation (WHO Technical Report Series 935). Weltgesundheitsorganisation, 2007, ISBN 92-4120935-6 (Volltext [PDF]).
- ↑ Gertjan Schaafsma: The Protein Digestibility–Corrected Amino Acid Score. In: The Journal of Nutrition. Band 130, Nr. 7, 2000, S. 1865S–1867S, doi:10.1093/jn/130.7.1865S (freier Volltext).
- ↑ C. P. Marinangeli, J. D. House: Potential impact of the digestible indispensable amino acid score as a measure of protein quality on dietary regulations and health. In: Nutrition reviews. Band 75, Nummer 8, August 2017, S. 658–667, doi:10.1093/nutrit/nux025, PMID 28969364, PMC 5914309 (freier Volltext) (Review).
- ↑ R. R. Wolfe, S. M. Rutherfurd, I. Y. Kim, P. J. Moughan: Protein quality as determined by the Digestible Indispensable Amino Acid Score: evaluation of factors underlying the calculation. In: Nutrition reviews. Band 74, Nr 9, 2016, S. 584–599, doi:10.1093/nutrit/nuw022, PMID 27452871 (Review).
- ↑ S. M. Phillips: The impact of protein quality on the promotion of resistance exercise-induced changes in muscle mass. In: Nutrition & metabolism. Band 13, 2016, S. 64, doi:10.1186/s12986-016-0124-8, PMID 27708684, PMC 5041535 (freier Volltext) (Review).
- ↑ Bedeutung, Definition und Berechnung des DIAAS. Wissenschaftlicher Bericht zur Biologischen Wertigkeit in deutscher Sprache - DIAAS; abgerufen am 24. August 2020.
- ↑ Benjamin Caballero (Hrsg.): Encyclopedia of Human Nutrition. Second Edition. 2005, Abschnitt „Protein: Requirements and Role in Diet“, S. 61.
- ↑ Daten und Fakten zu nachwachsenden Rohstoffen. Fachagentur Nachwachsende Rohstoffe e. V., Gülzow 2006, S. 57; fnr-server.de (PDF; 1,9 MB).
- ↑ Ralf Pude, Barbara Wenig: Pflanzen für die Industrie. Pflanzen, Rohstoffe, Produkte. Fachagentur Nachwachsende Rohstoffe e. V., Gülzow 2005, S. 11; fnr-server.de (PDF; 1,5 MB).
- ↑ Dominik Vogt, Christian Gahle, Michael Karus: Erstellung eines Überblicks zu Marktsituation und Trends zur stofflichen Nutzung nachwachsender Rohstoffe (NR) in Nordrhein-Westfalen. nova-Institut GmbH, Hürth 2005.
- ↑ K. Rappold: Gelatine – Ein natürliches Nahrungsmittel. In: bmi aktuell. 1/2004, Hrsg. Informationszentrale für Backmittel und Backgrundstoffe zur Herstellung von Brot und Feinen Backwaren e. V.
- ↑ a b Homepage Gelatine Manufacturers of Europe ( vom 9. Januar 2016 im Internet Archive), abgerufen am 18. September 2008.; (Nicht mehr aufrufbar).
- ↑ Johann Verbeek, Lisa van den Berg: Proteinous Bioplastics from Bloodmeal. In: bioplastics magazine. Nr. 5, 2008, S. 30.
- ↑ Casparus J. R. Verbeek, Lisa E. van den Berg: Development of Proteinous Bioplastics Using Bloodmeal. In: Journal of Polymers and the Environment. Band 19, Nr. 1, 2010, S. 1–10, doi:10.1007/s10924-010-0232-x (freier Volltext).
- ↑ Matthias Geuder: Biopolymere – Rohstoffe, Technologien, Anwendungen. (PDF; 7,0 MB) In: Biowerkstoff-Report. Okt./Nov./Dez. 2008, S. 46.
- ↑ Flottweg Industriezentrifugen für pflanzliche und tierische Proteine. Abgerufen am 22. Mai 2017.
- ↑ Extraktion von Sojaprotein-Isolat. Flottweg SE
- ↑ a b Claus Stäcker: Die Herren der Fliegen. ( vom 24. Februar 2013 im Internet Archive) Tagesschau (ARD).
- ↑ a b AgriProtein’s managing director sees maggots as next protein alternative. In: efeedlink.com. Abgerufen am 3. Februar 2016.
- ↑ Rob Fletcher: Fishmeal replacement scoops major award. In: fishnewseu.com. Fish News EU, 13. April 2012, archiviert vom ; abgerufen am 3. Februar 2016.
- ↑ Maggots are Turf over Surf animal feed alternative. In: Reuters. 16. März 2012 (reuters.com).
- ↑ PEA Award winners 2012 ( vom 4. Februar 2013 im Internet Archive).
- ↑ Claudia Bröll: Nachhaltige Geschäftsidee Made in South Africa. In: Frankfurter Allgemeine Zeitung. 15. August 2012 (faz.net).
- ↑ Jessica Hendy: Ancient protein analysis in archaeology. In: Science Advances. Band 7, Nr. 3, 2021, eabb9314, doi:10.1126/sciadv.abb9314.
- ↑ Michelle Starr: Scientists Claim to Have Found The First Known Extraterrestrial Protein in a Meteorite In: ScienceAlert.com, 2. März 2020 (englisch).
- ↑ Protein discovered inside a meteorite, Phys.org, 3. März 2020. Abgerufen am 4. März 2020 (englisch).
- ↑ arxiv:2002.11688