Enole
Enole sind chemische Verbindungen der allgemeinen Formel R1–CR2=CR3–OH, bei denen eine C-C-Doppelbindung mit einer Hydroxygruppe substituiert ist. Sie stehen über eine Keto-Enol-Tautomerie im Gleichgewicht mit der entsprechenden Carbonylverbindung.[1] Das einfachste Enol ist das instabile Ethenol, das sich sofort zu Acetaldehyd (Ethanal) umlagert.[2]
Bei Aceton liegen im Gleichgewicht 99,9998 % der Keto- (links) und 0,0002 % der Enol-Form (rechts) vor:[3]
Die Hydroxygruppe ist schwach sauer, da die negative Ladung des Enolats mesomeriestabilisiert ist.
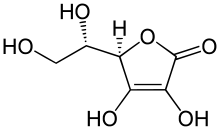
Sind beide Kohlenstoffatome mit einer Hydroxygruppe substituiert, handelt es sich um Endiole. Beispiel dafür ist die Ascorbinsäure, bei der das Keto-Enol-Gleichgewicht fast vollständig auf der Enol-Seite liegt.[4]
Bei aliphatischen Enolen liegt das Gleichgewicht wegen der energetischen Begünstigung vollständig auf der Keto-Seite, weshalb Enole nur als Derivate vorkommen – beispielsweise als Phosphoenolpyruvat (PEP), dem Phosphorsäureester der enolisierten Brenztraubensäure. Aliphatische 1,3-Dicarbonyl-Verbindungen sind jedoch stärker enolisiert. So liegt 2,4-Pentandion (Acetylaceton) zu 76,4 % als cis-Enol vor, das über eine intramolekulare Wasserstoffbrücken-Bindung stabilisiert ist.[3] Auch das cyclische Endiol Ascorbinsäure liegt fast vollständig in der Enolform vor.
Bei den Phenolen ist die Enolform gegenüber der Ketoform aufgrund der Bildung eines aromatischen Systems bevorzugt (vgl. Hückel-Regel).
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ Bernd Schmidt, Jolanda Hermanns: Grundlagen der Organischen Chemie. Begründet von Joachim Buddrus. 6. überarbeitete Auflage. De Gruyter, Berlin, Boston 2022, ISBN 978-3-11-070087-9, S. 464.
- ↑ Eintrag zu Vinylalkohol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. März 2024.
- ↑ a b Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 377.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 869 (eingeschränkte Vorschau in der Google-Buchsuche).