Ketonkörper
| Ketonkörper (Beispiele) |
|---|
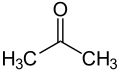 Aceton |
 3-Ketobuttersäure |
 (R)-3-Hydroxybuttersäure β-Hydroxybuttersäure |
Ketonkörper, auch Ketokörper, ist die Sammelbezeichnung für drei Verbindungen, die vor allem in katabolen Stoffwechsellagen (also Hungerzeiten, Fasten, kohlenhydratarme Ernährung oder kohlenhydratfreie Ernährung) gebildet werden.
Unter Ketonkörpern fasst man Acetoacetat (auch Acetacetat genannt), Aceton und β-Hydroxybutyrat bzw. 3-Hydroxybutyrat zusammen. Letztere Verbindung ist die bedeutendste der drei.
Die Ketonkörper werden in der Leber aus Acetyl-CoA gebildet, welches aus der β-Oxidation stammt. Sie stellen eine Form des Acetyl-CoAs dar, die aus der Leber exportiert und mit dem Blut im menschlichen Körper verteilt werden kann. Zur Verwertung der Ketonkörper müssen sich Gehirn und Muskeln aber zunächst umstellen, indem sie die Enzyme verstärkt bilden, die zur Rückwandlung von Ketonkörpern in Acetyl-CoA benötigt werden. Während des Fastens oder in Hungerzeiten tragen die Ketonkörper einen beträchtlichen Anteil zur Energiegewinnung bei. So ist es dem Gehirn nach einiger Zeit möglich, mit 40 Gramm anstatt mit 120 Gramm Glucose pro Tag auszukommen.
Metabolismus der Ketonkörper
BearbeitenKetogenese
BearbeitenDie Synthese der Ketonkörper erfolgt aus zwei Molekülen aktivierter Essigsäure, Acetyl-CoA, dem normalen Zwischenprodukt des Fettsäureabbaus. Zunächst wird mithilfe der Acetyl-CoA-Acetyltransferase das Acetoacetyl-CoA gebildet, welches unter Verwendung einer weiteren Acetyl-CoA-Einheit und des Enzyms HMG-CoA-Synthase zum Zwischenprodukt 3-Hydroxy-3-Methyl-Glutaryl-CoA (HMG-CoA) verlängert wird. Schließlich spaltet die HMG-CoA-Lyase das Acetoacetat ab. Diese drei Schritte finden ausschließlich in den Mitochondrien der Leber statt (Lynen-Zyklus). 3-Hydroxybutyrat entsteht schließlich im Zytosol durch die D-β-Hydroxybutyrat–Dehydrogenase.
HMG-CoA ist außerdem ein Endprodukt beim Abbau der Aminosäure Leucin, Acetoacetat entsteht beim Abbau der Aminosäuren Phenylalanin und Tyrosin.
Durch spontane Decarboxylierung entsteht aus Acetoacetat Aceton; es ist gelegentlich im Atem von Diabetikern und Diäthaltenden wahrzunehmen. Es kann vom Körper nur begrenzt weiterverwendet werden zur Gluconeogenese[1]. Der Anteil von Aceton an den Ketonkörpern ist allerdings gering.
Verstoffwechselung
BearbeitenAus D-β-Hydroxybutyrat kann mittels des Enzyms 3-Hydroxybutyrat-Dehydrogenase Acetoacetat gewonnen werden; die Reaktion ist leicht umkehrbar. Die 3-Ketosäure–CoA-Transferase überträgt CoA auf Acetoacetat, während gleichzeitig Succinat freigesetzt wird. Letztendlich wird aus Acetoacetyl-CoA und CoA zweimal Acetyl-CoA gewonnen; die Katalyse dieser Reaktion besorgt die Acetyl-CoA-Acetyltransferase, ebenfalls die Umkehrung einer bei der Synthese stattfindenden Reaktion.
Diese Aktivierung der Ketonkörper findet in der mitochondrialen Matrix aller Zellen statt, die Ketonkörper verarbeiten können, jedoch nicht in der Leber. Schließlich fließt das so gewonnene Acetyl-CoA in den Citratzyklus ein, wo daraus durch Oxidation Energie gewonnen wird.
Ketonkörper und Diabetes
BearbeitenBeim Diabetes mellitus Typ 1 (Zuckerkrankheit) findet man bei absolutem Insulinmangel vermehrt Ketonkörper im Urin (Ketonurie). Dies beruht auf einer zu hohen Konzentration derselben im Blut. Wie Glucose scheidet die Niere die Ketonkörper bei einer erhöhten Blutkonzentration aus.
Grund für die vermehrte Produktion der Ketonkörper ist der Mangel an Insulin: Obwohl eigentlich genügend Glucose im Blut vorhanden ist, kann diese ohne das Insulin nicht in die Zellen gelangen, da ohne Insulin der Einbau von GLUT-4 in die Plasmamembranen von Skelettmuskelzellen und Adipozyten ausbleibt[2]. Daher entsteht trotz erhöhten Blutzuckerspiegels im Blut in den Zellen ein Glucosemangel. Dies führt zum Abbau von Fett (Lipolyse) zur Energiegewinnung. Während Insulin den Abbau von Depotfett hemmt, fördert Insulinmangel den Fettabbau, die Lipolyse. Eine durch einen niedrigen Insulinspiegel induzierte Lipolyse ist typisch für den Hungerstoffwechsel. Ketonkörper werden gebildet, wenn das Abbauprodukt der Fettsäuren, Acetyl-CoA, aufgrund einer zu geringen Oxalacetatkonzentration nicht in den Citratzyklus eintreten kann. Oxalacetat kann in einer anaplerotischen Reaktion aus Pyruvat synthetisiert werden. Pyruvat ist das Endprodukt der Glykolyse. Der im Falle von Diabetes mellitus in den Zellen vorliegende niedrige Glucosespiegel führt zu geringen Mengen an Pyruvat und so zu geringen Mengen an Oxalacetat, was die Bildung von Ketonkörpern aus Acetyl-CoA begünstigt. Bei zu vielen Ketonkörpern im Blut sinkt dessen pH-Wert und es kommt zu einer Ketoazidose, welche im schlimmsten Fall zu einem ketoazidotischen Koma führt. Deswegen kommt es in der Regel nur beim Diabetes Mellitus Typ 1 zur Ketoazidose, da hier ein absoluter Insulinmangel herrscht. Beim Typ-2 Diabetes mit einem relativen Insulinmangel hat der Körper eine Insulinresistenz gebildet, wodurch vermehrt Insulin gebildet wird. Durch diese, wenn auch verringerte, Insulinwirkung kann der Körper die Bildung von Ketonkörpern vermeiden.
Ein typisches Symptom für eine Ketose ist der Geruch von Aceton (Nagellackentferner) in der Atemluft, da die Ketonkörper über diese abgeatmet werden.
Bei anhaltenden Hypoglykämien mit gleichzeitig erniedrigter Ketonkörperzahl im Blut muss hingegen an das Vorliegen einer Fettsäureoxidationsstörung gedacht werden. Beispiel hierfür ist ein Medium-Chain-Acyl-CoA-Dehydrogenase-Mangel.
Siehe auch
BearbeitenLiteratur
Bearbeiten- Berg/Tymoczko/Stryer: Biochemie. 5. Auflage, Spektrum Akademischer Verlag GmbH, Heidelberg 2003, ISBN 3-8274-1303-6.
Weblinks
Bearbeiten- Gopinathrao/reactome.org: Ketone body metabolism doi:10.3180/REACT_1861.2
- https://www.spektrum.de/lexikon/biologie/ketonkoerper/35945
Einzelnachweise
Bearbeiten- ↑ J. P. Casazza, M. E. Felver, R. L. Veech: The metabolism of acetone in rat. In: The Journal of Biological Chemistry. Band 259, Nr. 1, 10. Januar 1984, S. 231–236, PMID 6706932.
- ↑ Löffler, Petrides: Biochemie und Pathobiochemie. Hrsg.: Heinrich, Müller, Graeve. 9. Auflage. Springer, 2014, ISBN 978-3-642-17972-3, S. 154.