Mesodinium
Mesodinium (synonym Myrionecta) ist eine Gattung eukaryotischer Einzeller, die dem Stamm der Wimperntierchen angehört.[2][3][4][5] Mesodinium-Spezies (Arten) sind weit verbreitet und kommen reichlich in Meeres- und Brackwasser vor.[6][7] Derzeit sind ca. sechs Mesodinium-Arten beschrieben, allein marinen Umgebungen. Nach ihrer Ernährungsweise klassifiziert sind dies:
- plastidisch: M. chamaeleon, M. coatsi, M. major und M. rubrum – bei diesen Arten findet man Plastiden (Chloroplasten), in denen Photosynthese (Photoassimilation) stattfindet,
- heterotroph: M. pulex und M. pupula – diese Arten leben rein räuberisch.
| Mesodinium | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
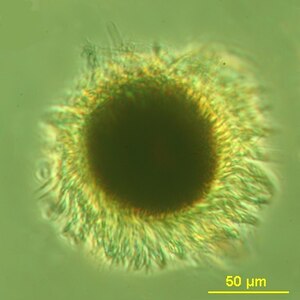
M. rubrum, Draufsicht. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Mesodinium | ||||||||||||
| Stein, 1862 |




Eine nicht einfach zu klärende Frage ist, ob sich die plastidischen Mesodinium-Arten phototroph ernähren (mit eigenen Dauerplastiden) oder mixotroph (mit temporären Kleptoplastiden, die immer wieder auf räuberische Weise ersetzt werden müssen).[8][9] Unter den plastidischen Arten besitzen die Wildtypen von M. major und M. rubrum rote Plastiden, die denen der Cryptophyceen-Gattungen Teleaulax, Plagioselmis und Geminigera (Geminigera/Plagioselmis/Teleaulax-Komplex, Familie Geminigeraceae) entsprechen.[10][11][12] M. rubrum enthält tatsächlich funktionelle Chloroplasten, die von Cryptophyceen-Arten der Gattungen Teleaulax und Geminigera stammen (Kleptoplastidie).[13] Die Wildpopulationen von M. chamaeleon und M. coatsi enthalten dagegen normalerweise grüne Plastiden.[14][15][16] Die Verfügbarkeit geeigneter Cryptophyceen-Beute ist eine wichtige Voraussetzung für die Bildung von Algenblüten durch die plastidischen Mesodinium-Arten.[1]
Die am häufigsten vorkommende Mesodinium-Art, M. rubrum (alias Myrionecta rubra), verursacht in vielen Küstenökosystemen „Rote Tiden“ genannte Algenblüten. Obwohl M. rubrum als ungiftige Art gilt,[17] können Blüten dieses Wimpertierchens für die Aquakulturindustrie potenziell schädlich sein.[18][19][1] M. rubrum betreibt Photosynthese, indem es den Zellkern seiner Cryptophyceen-Beute abtrennt, um „gestohlenen“ Plastiden und andere Organellen zu behalten und für sich zu nutzen.[20] Auf diese Weise spielt die Gattung Mesodinium eine wichtige Rolle, indem sie die eine Verbindung herstellt zwischen der Cryptophyceen-Beute und verschiedenen Räubern im aquatischen mikrobiellen Nahrungsnetz, wie beispielsweise Dinoflagellaten der Gattung Dinophysis. So ist etwa M. rubrum die Quelle der Plastiden verschiedener Dinophysis-Arten, die daher letztlich von den Cryptophyceen stammende Kleptoplastiden sind. So wurde zum Beispiel häufig beobachtet, dass hohe Dichten von Dinophysis-Arten vor oder gleichzeitig mit hohen Dichten von M. rubrum auftreten.[21][22][23][24][1]
Arten
BearbeitenDie Gattung Mesodinium Stein, 1862 (syn. Myrionecta) besteht aus folgenden Arten (A: AlgaeBase[3], N: NCBI[2], W: WoRMS[4], μ: SMHI – Nordic Microalgae and aquatic protozoa.[5], Stand: 12. Dezember 2021):
- Mesodinium acarus Stein, 1862[N,W] – alias Acarella siro Cohn, 1866 (nicht zu verwechseln mit Acarella siro Warberg, Wisby)[25][26]
- Mesodinium chamaeleon Moestrup, Garcia-Cuetos, Hansen & Fenchel, 2012[N,W][15][27][14]
- Mesodinium cinctum Calkins, 1902[W]
- Mesodinium coatsi Van As, Basson & Van As, 1998 – inkl. Mesodinium sp. SWN-2014[N][16]
- Mesodinium fimbriatum A.Stokes, 1885[A]
- Mesodinium major[1] – unter diesem Namen finden sich Nennungen mit unterschiedlicher Autorenschaft:
- Mesodinium pulex[14][28][29] – auch unter diesem Namen finden sich Nennungen mit unterschiedlicher Autorenschaft:
- M. pulex Claparède & Lachmann, 1858[W] bzw. (Claparède & Lachmann, 1859), Stein, 1867[30] bzw. Clap. & Lachm., 1858[31]
- M. pulex H.Tamar 1986[A] – da jedoch H. Tamar (1986) durch H. Tamar (1992) – mit Bezug auf den ersten Eintrag – ersetzt wird, ist dieser Eintrag obsolet. Damit können auch die folgenden Stämme, Isolate und Sequenzen aus NCBI dem ersten Eintrag zugeordnet werden:
- M. pulex isolate LWW08010306 Zhang, Gao et al. 2009[N][32]
- M. pulex strain HHJ Garcia-Cuetos et al. 2011[N][33]
- M. pulex Struder-Kypke et al. 2006[N][34]
- M. pulex strain QD-I Li & Song 2006[N][35]
- M. pulex clone MPCR99 Johnson 2004[N][36]
- Mesodinium pupula Kahl, 1933[N,W][14]
- Mesodinium rubrum (Lohmann, 1908) bzw. (Lohmann) Leegard 1908 bzw. Leegaard, 1915[14][18][9][6][17][19][21][1][8][37] – alias Myrionecta rubra Lohmann, 1908[A,N,W,μ][14][11][20][10][7][38] – inkl. Mesodinium rubrum CCMP2563 alias Myrionecta rubra CCMP2563[N]
- Mesodinium velox H.Tamar 1986[A]
- Mesodinium sp. MR-MAL01[N] – vorgeschlagene Art mit vorläufiger Bezeichnung
- Mesodinium sp. WWS-2009a[N] – vorgeschlagene Art mit vorläufiger Bezeichnung
Eine Typusart ist nicht festgelegt.[39] Nach World Register of Marine Species (WoRMS), übernommen vom National Center for Biotechnology Information (NCBI), ist die erste beschrieben Art Mesodinium acarus Stein, 1862; die am häufigsten vorkommende und am besten beschriebene Art ist jedoch M. rubrum (s. o.).
Siehe auch
BearbeitenLiteratur
Bearbeiten- María García-Portela, Beatriz Reguera, Manoella Sibat, Andreas Altenburger, Francisco Rodríguez, Philipp Hess: Metabolomic Profiles of Dinophysis acuminata and Dinophysis acuta Using Non-Targeted High-Resolution Mass Spectrometry: Effect of Nutritional Status and Prey. In: MDPI Marine Drugs, Band 16, Nr. 5, 26. April 2018, S. 143; doi:10.3390/md16050143. Siehe insbes. Phylogenie in Fig. 1.
Einzelnachweise
Bearbeiten- ↑ a b c d e f Goh Nishitani, Mineo Yamaguchi: Seasonal succession of ciliate Mesodinium spp. with red, green, or mixed plastids and their association with cryptophyte prey. In: Scientific Reports. Band 8, Nr. 17189, 21. November 2018, doi:10.1038/s41598-018-35629-4.
- ↑ a b NCBI: Mesodinium (genus); graphisch: Mesodinium,auf: Lifemap, NCBI versoin
- ↑ a b AlgaeBase: Mesodinium Stein, 1862.
- ↑ a b WoRMS: Mesodinium von Stein.
- ↑ a b SMHI: Mesodinium von Stein, Nordic Microalgae and aquatic protozoa.
- ↑ a b J.-M. Leppänen, J. E. Bruun: The role of pelagic ciliates including the autotrophic Mesodinium rubrum during the spring bloom of 1982 in the open northern Baltic proper. In: Ophelia. Band 4, 1986, S. 147–157.
- ↑ a b R. W. Sanders: Seasonal distributions of the photosynthesizing ciliates Laboea strobila and Myrionecta rubra (= Mesodinium rubrum) in an estuary of the Gulf of Maine. In: Aquatic Microbial Ecology. Band 9, 1995, S. 237–242.
- ↑ a b Dajun Qiu, Liangmin Huang, Senjie Lin: Cryptophyte farming by symbiotic ciliate host detected in situ. In: PNAS. Band 113, Nr. 43, 25. Oktober 2016, S. 12208-12213, doi:10.1073/pnas.1612483113, Epub 10. Oktober 2016.
- ↑ a b Matthew D. Johnson, Erica Lasek-Nesselquist, Holly V. Moeller, Andreas Altenburger, Nina Lundholm, Miran Kim, Kirstine Drumm, Øjvind Moestrup, Per Juel Hansen: Mesodinium rubrum: The symbiosis that wasn’t. In: PNAS. Band 114, Nr. 7, Stand 14. Februar 2017 (Erstveröffentlichung am 1. Februar 2017), S. E1040-E1042; doi:10.1073/pnas.1619247114.
- ↑ a b Goh Nishitani, Satoshi Nagai, Katsuhisa Baba, Susumu Kiyokawa, Yuki Kosaka, Kazuyoshi Miyamura, Tetsuya Nishikawa, Kiyonari Sakurada, Akiyoshi Shinada, Takashi Kamiyama: High-Level Congruence of Myrionecta rubra Prey and Dinophysis Species Plastid Identities as Revealed by Genetic Analyses of Isolates from Japanese Coastal Waters. In: ASM Journals: Appl. Environ. Microbiol. Band 76, Nr. 9, Mai 2010, S. 2791-2798, doi:10.1128/AEM.02566-09, PMID 20305031, PMC 2863437 (freier Volltext), Epub 19. März 2010 und 17. Dezember 2020.
- ↑ a b Lydie Herfort, Tawnya D. Peterson, Lee Ann McCue, Byron C. Crump, Fredrick G. Prahl, Antonio M. Baptista, Victoria Campbell, Rachel Warnick, Mikaela Selby, G. Curtis Roegner, Peter Zuber: Myrionecta rubra population genetic diversity and its cryptophyte chloroplast specifcity in recurrent red tides in the Columbia River estuary. In: Aquat. Microb. Ecol. (AME), Band 62, S. 85–97, Januar 2011, doi:10.3354/ame01460 (int-res.com, ResearchGate).
- ↑ a b Lydie Herfort, Katie Maxey, Ian Voorhees, Holly M. Simon, Kolette Grobler, Tawnya D. Peterson, Peter Zuber: Use of Highly Specific Molecular Markers Reveals Positive Correlation between Abundances of Mesodinium cf. major and Its Preferred Prey, Teleaulax amphioxeia, During Red Water Blooms in the Columbia River Estuary. In: J. Eukaryot. Microbiol. Band 64, S. 740–755, 4. März 2017, doi:10.1111/jeu.12407.
- ↑ Jong Im Kim, Hwan Su Yoon, Gangman Yi, Hyung Seop Kim, Wonho Yih, Woongghi Shin: The Plastid Genome of the Cryptomonad Teleaulax amphioxeia. In: PLOS ONE, Band 10, Nr. 6, 52015, e0129284, doi:10.1371/journal.pone.0129284, PMC 4457928 (freier Volltext), PMID 26047475.
- ↑ a b c d e f g Lydia Garcia-Cuetos, Øjvind Moestrup, Per J. Hansen: Studies on the genus Mesodinium II. Ultrastructural and molecular investigations of five marine species help clarifying the taxonomy. In: J. Eukaryot. Microbiol., Band 59, Nr. 4, S. 374–400, Juli/August 2012, doi:10.1111/j.1550-7408.2012.00630.x, PMID 22708786, Epub 18. Juni 2012.
- ↑ a b Øjvind Moestrup, Lydia Garcia-Cuetos, Per Juel Hansen, Tom Fenchel: Studies on the genus Mesodinium I: ultrastructure and description of Mesodinium chamaeleon n. sp., a benthic marine species with green or red chloroplasts. In: J. Eukaryot. Microbiol. Band 59, Nr. 1, 5. Januar 2012, S. 20–39, doi:10.1111/j.1550-7408.2011.00593.x.
- ↑ a b Seung Won Nam, Woongghi Shin, Misun Kang, Wonho Yih, Myung Gil Park: Ultrastructure and molecular phylogeny of Mesodinium coatsi sp. nov., a benthic marine ciliate. In: J. Eukaryot. Microbiol. Band 62, 22. Juli 2014, S. 102–120, doi:10.1111/jeu.12150, PMID 25047232, Epub 21. August 2014.
- ↑ a b Tore Lindholm: Mesodinium rubrum–a unique photosynthetic ciliate. In: Adv. Aquat. Microbiol. Band 3, 1985, S. 1–48 (Eintrag bei Pascal Francis), CNRS.
- ↑ a b G. C. Hayes, D. A. Purdie, J. A. Williams: The distribution of ichthyoplankton in Southampton Water in response to low oxygen levels produced by a Mesodinium rubrum bloom. In: J. Fish Biol., Band 34, Nr. 5, S. 811–813, Mai 1989, doi:10.1111/j.1095-8649.1989.tb03363.x
- ↑ a b Huaxue Liu, Xingyu Song, Liangmin Huang, Yehui Tan, Yu Zhong, Jian Rong Huang: Potential risk of Mesodinium rubrum bloom in the aquaculture area of Dapeng’ao cove, China: diurnal changes in the ciliate community structure in the surface water. In: Oceanologia, Band 54, Nr. 1, 10. Februar 2012, S. 109–117, doi:10.5697/oc.54-1.109.
- ↑ a b Matthew D. Johnson, David Oldach, Charles F. Delwiche, Diane K. Stoecker: Retention of transcriptionally active cryptophyte nuclei by the ciliate Myrionecta rubra. In: Nature. Band 445, S. 426–428, 25. Januar 2007, doi:10.1038/nature05496.
- ↑ a b Lone Thybo Mouritsen, Katherine Richardson: Vertical microscale patchiness in nano- and microplankton distributions in a stratifed estuary. In: J. Plankton Res. Band 25, Nr. 7, Juli 2003, S. 783–797, doi:10.1093/plankt/25.7.783.
- ↑ Conny O. Sjöqvist, Tore J. Lindholm: Natural co-occurrence of Dinophysis acuminata (Dinoflagellata) and Mesodinium rubrum (Ciliophora) in thin layers in a coastal inlet. In: J. Eukaryot. Microbiol. Band 58, Nr. 4, Juli/August 2011, S. 365–372, doi:10.1111/j.1550-7408.2011.00559.x, ResearchGate, PMID 21569163, Epub 13. Mai 2011.
- ↑ Urmas Lips, Inga Lips: Bimodal distribution patterns of motile phytoplankton in relation to physical processes and stratification (Gulf of Finland, Baltic Sea). In: Deep-Sea Res. II., Band 101, März 2014, S. 107–119, doi:10.1016/j.dsr2.2013.05.029, (idronaut.it PDF).
- ↑ Lourdes Velo-Suárez, Beatriz Reguera, Sonsoles González-Gil, Yolanda Pazos: The growth season of Dinophysis acuminata in an upwelling system embayment: a conceptual model based on in situ measurements. In: Topical Studies in Oceanography. Bamd 101, März 2014, S. 141–151, doi:10.1016/j.dsr2.2013.03.033.
- ↑ Erna Aescht: Denisia 1. In: Catalogue of the Generic Names of Ciliates (Protozoa, Ciliophora). Biologiezentrum/RZ Linz, Österreich, 23. Februar 2001, ISSN 1608-8700 (zobodat.at PDF).
- ↑ August Quennerstedt: Bidrag till Sveriges Infuisorie-fauna jemte en kort framställning af Infusionsdjurens organisation. I. In: Acta Universitas Luniensis. University of Illinois at Urbana-Champaign Library, Brittle Books Project, Epub 2012 (brittlebooks.library.illinois.edu PDF) schwedisch.
- ↑ Michael Marshall: Zoologger: Unique life form is half plant, half animal. Auf: NewScientist. 13. Januar 2012 (newscientist.com).
- ↑ NCBI: Mesodinium pulex (species).
- ↑ Encyclopedia of Life: Mesodinium pulex.
- ↑ Marine Species Identification Portal, Zooplankton of the South Atlantic Ocean; D. Boltovskoy (Hrsg.): Mesodinium pulex (Claparède and Lachmann, 1859), Stein, 1867.
- ↑ Henry Tamar: Four Marine Species of Mesodinium (Ciliophora: Mesodiniidae) II. Mesodinium pulex Clap. & Lachm., 1858. In: Archiv für Protistenkunde. Band 141, Nr. 4, Juni 1992, S. 284–303, doi:10.1016/S0003-9365(11)80058-8.
- ↑ NCBI: Mesodinium pulex 18S small subunit ribosomal RNA gene, partial sequence, Accession: JN412740.
- ↑ NCBI: Mesodinium pulex strain HHJ 18S small subunit ribosomal RNA gene, partial sequence; internal transcribed spacer and 5.8S ribosomal RNA gene, complete sequence; and 28S large subunit ribosomal RNA gene, partial sequence, Accession: FJ876973.
- ↑ NCBI: Mesodinium pulex small subunit ribosomal RNA gene, partial, Accession: FJ876973.
- ↑ NCBI: Mesodinium pulex strain QD-I small subunit ribosomal RNA gene, partial sequence, Accession: DQ845294.
- ↑ NCBI: Mesodinium pulex clone MPCR99 18S small subunit ribosomal RNA gene, partial sequence, Accession: AY587130.
- ↑ SMHI: Mesodinium rubrum (Lohmann, 1908), Nordic Microalgae and aquatic protozoa.
- ↑ Aditee Mitra: Meeresbiologie – Das Beste aus zwei Welten – Auf einen Blick: Halb Pflanze, halb Tier. In: Spektrum der Wissenschaft. April 2019, S. 54–57 (spektrum.de).
- ↑ AlgaeBase: Mesodinium rubrum (Lohmann) Leegard 1908.