Natriumchlorid-Struktur
Die Natriumchlorid-Struktur (Kochsalzstruktur) bzw. der Natriumchloridtyp ist einer der Strukturtypen der Kristallographie. Ihr Prototyp ist die Kristallstruktur von Natriumchlorid (Kochsalz, Halit) in der Raumgruppe Fm3m (Nummer 225). Ihr Pearson-Symbol ist cF8, ihre Strukturbericht-Bezeichnung B1.
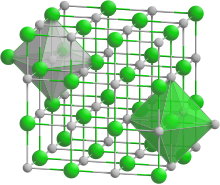
Sie ist für viele Salze typisch, weitere Vertreter dieses Strukturtyps sind z. B.
- Lithiumchlorid (LiCl)
- Kaliumchlorid (KCl, Sylvin)
- die meisten Erdalkalioxide wie MgO.
Ausnahmen, die nicht dem Natriumchloridtyp entsprechen, sind u. a. Caesiumhalogenide (bis auf Caesiumfluorid) und Berylliumoxid (BeO).
Aufbau
BearbeitenDie Elementarzelle der Natriumchlorid-Struktur entspricht einem Würfel. Entlang der x-, y- und z-Achse sind jeweils abwechselnd Natrium- und Chloridionen angeordnet. Jedes Natriumion ist damit oktaedrisch von sechs Chloridionen umgeben und umgekehrt jedes Chloridion oktaedrisch von sechs Natriumionen.
Man kann die Natriumchlorid-Struktur auch als kubisch dichteste Kugelpackung (engl. cubic closest packed (ccp)) der größeren Anionen ansehen, in der die kleineren Kationen die Oktaederlücken besetzen.
Dieser Strukturtyp ist eindeutig beschrieben durch:
- das kubisch flächenzentrierte Gitter (fcc) als Punkt- bzw. Translationsgitter mit
- den kanonischen Einheitsvektoren ( , , ) als Gittervektoren
- als Gitterparameter (Abstand zweier gleichartiger Atome / Ionen)
- die Basis, die jeden Gitterpunkt besetzt:
- Na+ bei , also auf den Gitterpunkten des fcc-Gitters
- Cl− bei , also im Zentrum der fcc-Einheitszelle mit Kantenlänge .
Bei anderen Stoffen unterscheidet sich lediglich die Art der Ionen auf den entsprechenden Gitterplätzen, wobei auch unterschiedliche Ionenradien auftreten. Das Verhältnis dieser Ionenradien ist dabei ein wichtiges Kriterium zur Herausbildung eines Natriumchloridtyps.
Der Gitterparameter beträgt bei Natriumchlorid und Zimmertemperatur ungefähr 0,564 nm (5,64 Å). NaCl-Kristalle, die in der ISS unter Mikrogravitation gewachsen sind, haben dieselbe Kristallstruktur mit identischen Gitterparametern.[1]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Pietro Fontana, Jürg Schefer, Donald Pettit: Characterization of sodium chloride crystals grown in microgravity. In: Journal of Crystal Growth. Band 324, 2011, S. 207–211, doi:10.1016/j.jcrysgro.2011.04.001.
Literatur
Bearbeiten- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3.
- Pietro Fontana, Die Vielfalt der Salzkristalle. Solothurn 2013, ISBN 978-3-033-04031-1