Trypanosoma brucei
Trypanosoma brucei ist eine Art von einzelligen Parasiten, die als Krankheitserreger der Afrikanischen Schlafkrankheit beim Menschen medizinische Bedeutung hat. In Endemiegebieten in Afrika zirkuliert der Parasit zwischen blutsaugenden Tsetsefliegen und verschiedenen Säugetierarten, einschließlich Haustieren.[1] Eine Unterart von Trypanosoma brucei ist ein Erreger der Tierseuche Nagana, die in Afrika ein großes Problem für die Viehzucht ist. Die Parasiten haben einen ausgesprochen komplexen Lebenszyklus mit verschiedenen Lebensformen in Insekten und Säugetieren. Trypanosoma brucei zeichnet sich auch durch molekulare Besonderheiten bei der Regulation der Genexpression und bei der Vermeidung der Immunantwort des Säugetierwirtes aus.
| Trypanosoma brucei | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
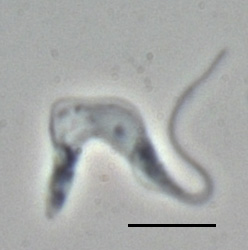
Trypanosoma brucei brucei Phasenkontrastaufnahme eines Trypomastigoten; Balken 10 µm | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Trypanosoma brucei | ||||||||||||
| Plimmer & Bradford, 1899 |
Entdeckung und Beschreibung
BearbeitenGeschichte
BearbeitenAfrikanische Trypanosomen wurden erstmals 1895 vom Arzt David Bruce im Blut von an Nagana erkrankten Rindern beobachtet und als Auslöser der Erkrankung identifiziert.[2] Auch die Übertragung durch Tsetsefliegen konnte Bruce zeigen. Der Erreger wurde zu Ehren von Bruce Trypanosoma brucei (Synonym: Trypanosoma hominis) genannt. Wenige Jahre später wurden Trypanosomen in an der Westafrikanischen Schlafkrankheit erkrankten Menschen identifiziert; der 1902 von Aldo Castellani als Ursache der Schlafkrankheit[3] erkannte Erreger wurde nach dem westafrikanischen Fluss Gambia Trypanosoma gambiense genannt; dort wurde der Parasit zum ersten Mal identifiziert. Auch bei an der Ostafrikanischen Schlafkrankheit erkrankten Patienten wurden (zuerst von Robert Koch[4]) Trypanosomen gefunden, die nach der britischen Kolonie Nordrhodesien, dem Ort der ersten Identifizierung, Trypanosoma rhodesiense genannt wurden. Die drei ursprünglich identifizierten Arten wurden 1972 zu einer Art unter dem Namen Trypanosoma brucei zusammengefasst, die wiederum in drei Unterarten, Trypanosoma brucei brucei, Trypanosoma brucei gambiense und Trypanosoma brucei rhodesiense aufgeteilt wurde.
Morphologie
BearbeitenDer Einzeller hat eine einzelne Geißel, die an der Zelloberfläche unter einer undulierenden Membran zum Vorderende der Zelle verläuft und dort bei den meisten Formen des Parasiten zu einer freischwingenden Geißel wird. Ferner haben die Zellen einen kleinen Kinetoplasten, einer Ansammlung von DNA innerhalb eines großen Mitochondriums. Der Parasit kommt in mehreren pleomorphen Zellformen vor:
- Die trypomastigote Form, bei der die Basis der Geißel posterior zum Zellkern liegt, kommt im Blut von Säugetieren entweder als schlanke, bis zu 40 µm lange Form (slender) mit langer, freier Geißel und subterminalem Kinetoplast oder als kurze, gedrungene, bis zu 25 µm lange Form (stumpy) ohne freies Geißelende sowie einem Kinetoplasten nahe dem posterioren Ende vor; dazwischen gibt es noch intermediäre Formen. Ferner unterscheidet man eine prozyklische und eine metazyklische Form; beide kommen in Tsetse-Fliegen vor. Die metazyklische Form hat keine freie Geißel.
- Die epimastigote Form, bei der die Geißelbasis und der Kinetoplast anterior zum Zellkern liegt, ist der trypomastigoten ansonsten ähnlich und kommt ebenfalls nur in Fliegen vor.
Mikroskopisch sind die drei Unterarten nicht zu unterscheiden. Auch die Arten Trypanosoma evansi, Erreger der Surra, und Trypanosoma equiperdum, Erreger der Beschälseuche, sind mikroskopisch nicht von Trypanosoma brucei unterscheidbar.
Systematik
BearbeitenInnerhalb der Gattung Trypanosoma wird Trypanosoma brucei zusammen mit Trypanosoma evansi und Trypanosoma equiperdum in die Untergattung Trypanozoon eingeordnet. Unterhalb der Art werden drei Unterarten und weitere Gruppen ohne taxonomischen Rang unterschieden:[5]
- Trypanosoma brucei
- Trypanosoma brucei brucei (ehemals Trypanosoma brucei)
- „Brucei“
- „Kiboko“
- „Sindo“
- Trypanosoma brucei gambiense (ehemals Trypanosoma gambiense)
- „Group 1“
- „Group 2“
- Trypanosoma brucei rhodesiense (ehemals Trypanosoma rhodesiense)
- „Northern“
- „Southern“
- Trypanosoma brucei brucei (ehemals Trypanosoma brucei)
Verschiedene molekulare Untersuchungen ergaben, dass die Unterschiede zwischen den Unterarten von Trypanosoma brucei, aber auch zwischen allen anderen Vertreter der Untergattung Trypanozoon, sehr gering sind.[5] Trypanosoma brucei brucei und Trypanosoma brucei rhodesiense sind im Wesentlichen durch ein einziges Gen für einen Serum Resistance Associated (SRA)-Faktor verschieden. Wird das Gen für diesen Faktor auf Trypanosoma brucei brucei übertragen, so wird dieser Parasit für den Menschen infektiös. Das SRA-Protein gehört zur Familie der Variable Surface Glycoproteine (VSG). Es wird angenommen, dass das SRA-Gen von Trypanosoma brucei rhodesiense durch partielle Deletion in einem VSG-Gen von Trypanosoma brucei brucei entstanden ist und dann zwischen verschiedenen Trypanosoma brucei-Stämmen durch Rekombination verbreitet wurde.[6]
Trypanosoma evansi und Trypanosoma equiperdum unterscheiden sich von Trypanosoma brucei praktisch nur durch vollständiges (evansi) oder teilweises (equiperdum) Fehlen der kDNA-Maxicircles, einer mitochondrialen DNA. Dieser Unterschied hat aber zur Konsequenz, dass sich beide Arten nicht in Tsetsefliegen vermehren können; sie werden rein mechanisch übertragen. Die geringen molekularen Unterschiede innerhalb der Untergattung Trypanozoon würden für sich genommen kaum eine weitere taxonomische Differenzierung rechtfertigen; allerdings führen diese Unterschiede zu deutlich verschiedener Wirtsspezifität und unterschiedlichem Krankheitsverlauf, womit der Unterscheidung große praktische Bedeutung zukommt.
Verbreitung und Wirtstiere
BearbeitenAlle drei Unterarten von Trypanosoma brucei kommen praktisch ausschließlich in Afrika südlich der Sahara im Verbreitungsgebiet der Tsetsefliege, im sogenannten Tsetsegürtel, vor. Die Verbreitungsgebiete von Trypanosoma brucei gambiense und Trypanosoma brucei rhodesiense sind durch den ostafrikanischen Grabenbruch getrennt; lediglich in Uganda werden beide Unterarten beobachtet, allerdings in getrennten Verbreitungsgebieten. Trypanosoma brucei brucei ist im gesamten Tsetsegebiet anzutreffen.
Für Trypanosoma brucei gambiense ist der Mensch das Hauptreservoir.[7] Der Erreger wurde zwar auch aus Schweinen und Schafen, in Einzelfällen auch aus Affen isoliert, die epidemiologische Bedeutung als Reservoir ist aber umstritten. Affen können experimentell infiziert werden, ohne ernsthaft zu erkranken. Übertragen werden diese Parasiten von Fliegen der Glossina palpalis-Gruppe, die vorwiegend in der Nähe von Flussläufen leben. Der Grund für die Anfälligkeit des Menschen für die Infektion mit diesem Erreger liegt in der Resistenz des Erregers gegen zwei menschliche Proteine, die trypanolytischen Faktoren (TLF-1 und TLF-2).[8]
Für Trypanosoma brucei rhodesiense ist das Rind das Hauptreservoir;[9] in Epidemiegebieten können bis zu 20 Prozent der Rinder akut oder auch chronisch mit humanpathogenen Parasiten infiziert sein. Neben dem Rind sind Haustiere wie das Schwein oder die Ziege weitere Reservoirs. Auch aus verschiedenen Wildtiere, beispielsweise dem Buschbock und anderen Antilopen, wurden oft Parasiten isoliert. Epidemiologisch spielen Wildtiere aufgrund der zurückgehenden Verbreitungsräume der Tiere keine dominierende Rolle mehr, es können aber ausgehend von Wildtierreservoirs Haustiere und in der Folge Menschen infiziert werden. Eine experimentelle Infektion ist bei Affen möglich und in den meisten Fällen tödlich. Die Übertragung erfolgt durch Fliegen der Glossina morsitans-Gruppe, die vorwiegend in der Savanne leben, sowie durch Bremsen der Gattung Chrysops[10].
Trypanosoma brucei brucei kann viele Haussäugetiere, Kamele, sowie zahlreiche Wildtiere, darunter verschiedene Antilopen und einige Karnivoren, aber nicht den Menschen infizieren. Der Verlauf der Infektion ist sehr unterschiedlich; so zeigen manche westafrikanischen Hausrind-Rassen kaum Krankheitszeichen, während ostafrikanische Zebu-Rinder besonders empfindlich sind. Infektionen bei Pferden, Kamelen, Hunden und Katzen verlaufen meist schwer und sind oft tödlich.[11] Für die Resistenz des Menschen gegenüber Trypanosoma brucei brucei und mancher anderer Trypanosomen ist das Apolipoprotein L-I (APOL1) verantwortlich, ein Protein, das zuerst beim Menschen und bei Gorillas gefunden wurde.[12][13] Wenn Trypanosomen APOL1 durch Endozytose aufnehmen, bildet APOL1 in der Membran der Lysosomen Poren, die zu einer Lyse der Parasitenzellen führen. Erkauft wird dieser Selektionsvorteil aber durch ein erhöhtes Risiko, an bestimmten Nierenkrankheiten (Nephrosklerose, Fokal segmentale Glomerulosklerose) zu erkranken, deren Häufigkeit bei Menschen schwarzafrikanischer Abstammung entsprechend erhöht ist.[14] Die Serumresistenz des Menschen durch APOL1 wird von Trypanosoma brucei rhodesiense mittels des Serum Resistance Associated (SRA)-Faktors überwunden, indem das SRA-Protein an das Apolipoprotein bindet und dessen trypanolytische Wirkung neutralisiert. Trypanosoma brucei gambiense hat kein SRA; der Mechanismus der Serumresistenz bei dieser Unterart ist unbekannt.
Trypanosomen können prinzipiell auch mechanisch übertragen werden, beispielsweise durch medizinisches Besteck. Eine Übertragung von der Mutter auf den Embryo kommt vor, spielt jedoch epidemiologisch keine Rolle; eine Übertragung durch Transfusionen erscheint möglich, ist aber nicht dokumentiert. Eine rein mechanische Übertragung durch Wadenstecher ist experimentell nachgewiesen,[15] die epidemiologische Bedeutung aber unklar. Es gibt aber Hinweise auf Fälle der Nagana mit Trypanosome brucei. außerhalb des Tsetse-Verbreitungsgebietes.
Lebenszyklus
BearbeitenTrypanosoma brucei vermehrt sich ausschließlich extrazellulär. Nach dem Stich einer infizierten Tsetsefliege gelangen mit dem Speichel metazyklische trypomastigote Zellen ins Gewebe des Säugetierwirtes, wo sie sich im Zellzwischenraum zu schlanken Trypomastigoten umwandeln und durch Längsteilung vermehren. Von dort gelangen die Zellen ins lymphatische System und in die Blutbahn, wo sie sich weiter vermehren. Im weiteren Verlauf der Infektion wandeln sich die schlanken Trypomastigote teilweise in kurze, gedrungene Trypomastigote um; diese vermehren sich nicht mehr, sind aber infektiös für die Fliegen. Ausgehend von den Parasiten im Blutstrom kann auch das zentrale Nervensystem befallen werden, was dann zu den Symptomen der Afrikanischen Schlafkrankheit führt.
Wenn eine Tsetsefliege ein infiziertes Säugetier sticht, kann sie auf diesem Wege mit dem Blut Parasitenzellen aufnehmen. Durch solch eine Blutmahlzeit aufgenommene gedrungene Trypomastigote wandeln sich in der Fliege im Mitteldarm zu prozyklischen Trypomastigoten um. Dabei ändert sich massiv die Zelloberfläche des Parasiten: die Hülle aus variablen Oberflächenglykoproteinen wird durch einen Oberflächenmantel aus Prozyklin-Protein ausgetauscht; gleichzeitig wird der Energiestoffwechsel von einer in einem speziellen Organell, dem Glycosom ablaufenden glykolytischen auf eine oxidative ATP-Generierung im Mitochondrium umgestellt.[16]
Die prozyklischen Trypomastigoten vermehren sich im Darm der Fliege, wandeln sich zu Epimastigoten um und wandern in die Speicheldrüse, wo sie sich weiter vermehren. Epimastigote sind die einzige Form des Parasiten, die durch Rekombination genetische Informationen austauschen können; Mehrfachinfektionen mit verschiedenen Trypanosomen werden in Tsetsefliegen häufig beobachtet, sodass ein regelmäßiger genetischer Austausch möglich erscheint. Aus den Epimastigoten entstehen schließlich in der Speicheldrüse neue metazyklische trypomastigote Zellen, die erneut eine Hülle aus variablen Oberflächenglykoproteinen tragen. Diese Zellen können über den Speichel der Fliege nach einem Stich einen neuen Säugetierwirt infizieren. Der Vermehrungszyklus in der Fliege dauert 20 bis 40 Tage; die Fliegen bleiben für ihre gesamte Lebensdauer infektiös.
Molekulare Eigenschaften und Therapie
BearbeitenDie vollständige Genom-DNA-Sequenz von Trypanosoma brucei brucei wurde im Jahr 2005 publiziert. Das 26 Megabasenpaare große Genom in 11 großen Chromosomen enthält zirka 9.000 verschiedene Gene, von denen allerdings die Hälfte keine bekannte Funktion hat.[17] Neben den großen Chromosomen gibt es noch intermediäre Chromosomen und Minichromosomen. Das Genom wird großenteils zu polycistronischen mRNAs transkribiert; dies ist bei Eukaryoten sehr ungewöhnlich. Auch das Transspleißen, bei dem Exons verschiedener Transkripte zusammengefügt werden, ist eine besondere Eigenschaft der Trypanosomen, die bei anderen Eukaryoten selten beobachtet wird.[18]
Das Genom von Trypanosoma brucei enthält mehr als 1000 Gene für Variable Surface Glycoproteine (VSG). Der Parasit kann durch häufigen Wechsel der Genexpression der verschiedenen VSG-Gene seine Zelloberfläche periodisch verändern und so der spezifischen Immunantwort des Immunsystems des Säugetierwirtes ausweichen. Allerdings scheinen die meisten dieser VSG-Gene Pseudogene zu sein.[19] Neben der Antigenvariation spielen auch hydrodynamische Effekte, durch die die Trypanosomen Antikörper des Wirtes von ihrer Hülle abstreifen können, eine Rolle beim Ausweichen vor der Aktivität des Immunsystems.[20]
Vier Arzneistoffe gegen Trypanosoma brucei stehen für die Humanmedizin zur Verfügung und deren Anwendung sollte nur nach Rücksprache mit einem therapieerfahrenen Zentrum erfolgen. Alle vier haben schwere Nebenwirkungen; auch Resistenzen werden vermehrt beobachtet. Von den derzeit verwendeten Substanzen hat nur Eflornithin (eingesetzt vor allem bei Trypanosoma brucei gambiense im zweiten, enzephalitischen, Stadium[21]) einen spezifischen Wirkmechanismus als Inhibitor des Enzyms Ornithin-Decarboxylase. Pentamidin (insbesondere bei Trypanosoma brucei gambiense im ersten, hämo-lymphatischen, Stadium[22]), Suramin (insbesondere bei Trypanosoma brucei rhodesiense im ersten Stadium) und (als Alternative zu Eflornithin sowie bei Trypanosoma brucei rhodesiense im zweiten Stadium)[23] Melarsoprol wirken relativ unspezifisch; die Wirksamkeit wird einer selektiven Aufnahme der Arzneistoffe durch die Trypanosomen zugeschrieben.[24] Gleiches gilt für die in der Tiermedizin verwendeten Substanzen Diminazen und Ethidiumbromid. Das früher verwendete Tryparsamid wird aufgrund von Resistenzen und schweren Nebenwirkungen seit Anfang der 1970er Jahre nicht mehr eingesetzt.
Es besteht somit ein dringender Bedarf an neuen Antiprotozoika, die gegen Trypanosoma brucei wirksam sind. Neue Arzneistoffe gegen Trypanosomen sind seit Jahrzehnten nicht mehr entwickelt worden, obwohl es mit den Kinetoplasten, den Glycosomen und dem Transspleißen eine Reihe spezifischer biologischer Prozesse und Strukturen gibt. Als aussichtsreiches Target für die Pharmaforschung gilt zurzeit der Mechanismus der Purin-Aufnahme durch die Trypanosomen;[24] Trypanosoma brucei ist nicht in der Lage, Purine selbst zu synthetisieren und muss diese aus der Körperflüssigkeit des Wirtes aufnehmen.
Siehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ August Stich, Dietmar Steverding: Die Rückkehr einer Seuche: Trypanosomen. In: Biologie in unserer Zeit. Band 32, Nr. 5, 2002, S. 294–302. doi:10.1002/1521-415X(200209)32:5<294::AID-BIUZ294>3.0.CO;2-G
- ↑ D. Steverding: The history of African trypanosomiasis. In: Parasit Vectors. 1(1), 12. Feb 2008, S. 3. PMID 18275594
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 56.
- ↑ Gundolf Keil: Robert Koch (1843–1910). Ein Essai. In: Medizinhistorische Mitteilungen. Zeitschrift für Wissenschaftsgeschichte und Fachprosaforschung. Band 36/37, 2017/2018 (2021), S. 73–109, hier: S. 80.
- ↑ a b W. Gibson: Resolution of the species problem in African trypanosomes. In: Int J Parasitol. 37(8-9), Jul 2007, S. 829–838. PMID 17451719.
- ↑ W. C. Gibson: The SRA gene: the key to understanding the nature of Trypanosoma brucei rhodesiense. In: Parasitology. 131(Pt 2), Aug 2005, S. 143–150. PMID 16145931
- ↑ J. Pépin, H. A. Méda: The epidemiology and control of human African trypanosomiasis. In: Adv Parasitol. 49, 2001, S. 71–132. PMID 11461032
- ↑ Pierrick Uzureau, Sophie Uzureau u. a.: Mechanism of Trypanosoma brucei gambiense resistance to human serum. In: Nature. 501, 2013, S. 430–434, doi:10.1038/nature12516.
- ↑ E. M. Fèvre, K. Picozzi, J. Jannin, S. C. Welburn, I. Maudlin: Human African trypanosomiasis: Epidemiology and control. In: Adv Parasitol. 61, 2006, S. 167–221. PMID 16735165
- ↑ Vonnie D.C. Shields: Biological Control of Pest and Vector Insects. InTech, Riejka 2017, ISBN 9789535130352, S. 293.
- ↑ C. J. Maré: African animal trypanosomiasis. In: United States Animal Health Association (Hrsg.): Foreign Animal Diseases. St. Joseph, MO, 1998.
- ↑ Cassandra Willyard: Putting sleeping sickness to bed. In: nature.com. 7. Januar 2011, abgerufen am 21. Mai 2015 (englisch).
- ↑ E. Pays, B. Vanhollebeke, L. Vanhamme, F. Paturiaux-Hanocq, D. P. Nolan, D. Pérez-Morga: The trypanolytic factor of human serum. In: Nat Rev Microbiol. 4(6), Jun 2006, S. 477–486. PMID 16710327
- ↑ G. Genovese u. a.: Association of trypanolytic ApoL1 variants with kidney disease in African Americans. In: Science. Band 329, Nr. 5993, 13. August 2010, S. 841–845, doi:10.1126/science.1193032, PMID 20647424.
- ↑ S. Mihok, O. Maramba, E. Munyoki, J. Kagoiya: Mechanical transmission of Trypanosoma spp. by African Stomoxyinae (Diptera: Muscidae). In: Trop Med Parasitol. 46(2), Jun 1995, S. 103–105. PMID 8525279
- ↑ K. Fenn, K. R. Matthews: The cell biology of Trypanosoma brucei differentiation. In: Curr Opin Microbiol. 10(6), Dec 2007, S. 539–546. PMID 17997129
- ↑ M. Berriman, E. Ghedin, C. Hertz-Fowler u. a.: The genome of the African trypanosome Trypanosoma brucei. In: Science. 309(5733), 15 Jul 2005, S. 416–422. PMID 16020726
- ↑ S. Haile, B. Papadopoulou: Developmental regulation of gene expression in trypanosomatid parasitic protozoa. In: Curr Opin Microbiol. 10(6), Dec 2007, S. 569–577. PMID 18177626
- ↑ J. E. Taylor, G. Rudenko: Switching trypanosome coats: what's in the wardrobe? In: Trends Genet. 22(11), Nov 2006, S. 614–620. PMID 16908087
- ↑ M. Engstler, T. Pfohl, S. Herminghaus, M. Boshart, G. Wiegertjes, N. Heddergott, P. Overath: Hydrodynamic flow-mediated protein sorting on the cell surface of trypanosomes. In: Cell. 131(3), 2 Nov 2007, S. 505–515. PMID 17981118
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 295.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 295.
- ↑ Marianne Abele-Horn (2009), S. 295.
- ↑ a b A. Lüscher, H. P. de Koning, P. Mäser: Chemotherapeutic strategies against Trypanosoma brucei: drug targets vs. drug targeting. In: Curr Pharm Des. 13(6), 2007, S. 555–567. PMID 17346174
Literatur
Bearbeiten- Ian Maudlin, P. H. Holmes, Michael A. Miles (Hrsg.): The Trypanosomiases. CABI Publishing, Wallingford 2004, ISBN 0-85199-475-X