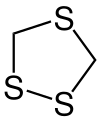
1,2,4-Trithiolan
1,2,4-Trithiolan ist ein Naturstoff und eine heterocyclische Verbindung, die in ihrem Fünfring sowohl eine Sulfid- als auch eine Disulfid-Funktion aufweist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1,2,4-Trithiolan | ||||||||||||
| Summenformel | C2H4S3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 124,3 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Vorkommen
Bearbeiten1,2,4-Trithiolan ist eine wichtige Aromakomponente in frischen und getrockneten Shiitake-Pilzen[2][3] und kommt in kleiner Menge in weißen Trüffeln, jedoch nicht in schwarzen Trüffeln vor.[4] Es ist auch eine Aromakomponente in Eiern.[5] Die Verbindung kommt in gekochten Bohnen von Parkia speciosa vor, sowie zu etwa 4,75 % in deren ätherischem Öl vor.[6][7] Außerdem nachgewiesen wurde sie der Rotalge Chondria californica.[8]
Gewinnung und Entstehung
Bearbeiten1,2,4-Trithiolan entsteht zum Teil bei der Entschwefelung von Erdöl, wenn hierzu Formaldehyd verwendet wird.[9]
Eigenschaften
BearbeitenIn der bevorzugten Konformation weist der Fünfring der Verbindung eine C2-Symmetrie auf. Die S-S-Bindungslänge beträgt. 2,044 Å.[10]
Chemische Eigenschaften
BearbeitenDurch Oxidation mit einem Äquivalent meta-Chlorperbenzoesäure entsteht überwiegend das 4-Sulfoxid; mit 2,5 Äquivalenten Oxidationsmittel fast ausschließlich das 1,2,4-Trithiolan-1,4-disulfoxid.[S 1][11] Mit Platin(0)-Komplexen reagiert die Verbindung unter Insertion in die S-S-Bindung und Ringkontraktion unter Abspaltung von Thioformaldehyd.[S 2][12]
Physiologische Eigenschaften
BearbeitenBeim Verzehr von Lebensmitteln, die 1,2,4-Trithiolan enthalten, reagiert dieses mit Glutathion und setzt dabei langsam Schwefelwasserstoff frei.[6]
Verwendung
Bearbeiten1,2,4-Trithiolan mit einer Reinheit von mindestens 95 % ist in der EU unter der FL-Nummer 15.111 als Aromastoff für Lebensmittel allgemein zugelassen.[13]
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Masakazu Hiraide, Yoshifumi Miyazaki, Yasushi Shibata: The smell and odorous components of dried shiitake mushroom, Lentinula edodes I: relationship between sensory evaluations and amounts of odorous components. In: Journal of Wood Science. Band 50, Nr. 4, August 2004, S. 358–364, doi:10.1007/s10086-003-0568-0.
- ↑ Chu Chin Chen, Chi Tang Ho: Identification of sulfurous compounds of Shiitake mushroom (Lentinus edodes Sing.). In: Journal of Agricultural and Food Chemistry. Band 34, Nr. 5, September 1986, S. 830–833, doi:10.1021/jf00071a016.
- ↑ Fabio Pelusio, Torben Nilsson, Luca Montanarella, Roberto Tilio, Bo Larsen, Sergio Facchetti, Jorgen Madsen: Headspace Solid-Phase Microextraction Analysis of Volatile Organic Sulfur Compounds in Black and White Truffle Aroma. In: Journal of Agricultural and Food Chemistry. Band 43, Nr. 8, August 1995, S. 2138–2143, doi:10.1021/jf00056a034.
- ↑ Victor Gil, Alexander J. MacLeod: Synthesis and assessment of three compounds suspected as egg aroma volatiles. In: Journal of Agricultural and Food Chemistry. Band 29, Nr. 3, Mai 1981, S. 484–488, doi:10.1021/jf00105a011.
- ↑ a b Dong Liang, Jinsong Bian, Lih-Wen Deng, Dejian Huang: Cyclic polysulphide 1,2,4-trithiolane from stinky bean (Parkia speciosa seeds) is a slow releasing hydrogen sulphide (H2S) donor. In: Journal of Functional Foods. Band 35, August 2017, S. 197–204, doi:10.1016/j.jff.2017.05.040.
- ↑ Mitsuo Miyazawa, Fitriyah Osman: Headspace Constituents of Parkia speciosa Seeds. In: Natural Product Letters. Band 15, Nr. 3, August 2001, S. 171–176, doi:10.1080/10575630108041277.
- ↑ Stephen J. Wratten, D. John Faulkner: Cyclic polysulfides from the red alga Chondria californica. In: The Journal of Organic Chemistry. Band 41, Nr. 14, Juli 1976, S. 2465–2467, doi:10.1021/jo00876a025.
- ↑ S. A. Leont’eva, E. V. Podlesnova, A. A. Botin, E. I. Alatortsev, A. A. Dmitrieva: Determination of 1,2,4-Trithiolane in Oil and Petroleum Products by Gas Chromatography. In: Journal of Analytical Chemistry. Band 74, Nr. 12, Dezember 2019, S. 1209–1212, doi:10.1134/S1061934819120062.
- ↑ Donald G. Borseth, Kurt W. Hillig, Robert L. Kuczkowski: The microwave spectrum, structure, and electric dipole moment of 1,2,4-trithiolane. In: Journal of the American Chemical Society. Band 106, Nr. 4, Februar 1984, S. 841–844, doi:10.1021/ja00316a002.
- ↑ Holm Petzold, Silvio Bräutigam, Helmar Görls, Wolfgang Weigand, Ute Uhlemann, Ralph Geßner, Wolfgang Kiefer, Jürgen Popp, Agnieszka Majchrzak, Grzegorz Mloston: Oxidations of sulfur rich heterocycles – new S-oxides of the parent 1,2,4-trithiolane and its tetramethyl derivative: synthesis and structural investigations. In: Inorganica Chimica Acta. Band 357, Nr. 6, April 2004, S. 1897–1908, doi:10.1016/j.ica.2003.12.004.
- ↑ Holm Petzold, Thomas Weisheit, Silvio Bräutigam, Helmar Görls, Grzegorz Mloston, Wolfgang Weigand: Reactions of 1,2,4‐Trithiolane and Its 4‐ S ‐Oxide with Diphosphane Pt 0 Complexes. In: European Journal of Inorganic Chemistry. Band 2010, Nr. 23, August 2010, S. 3636–3641, doi:10.1002/ejic.200901229.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 25. August 2023.