Silberthiocyanat
Silberthiocyanat das Silbersalz der Thiocyansäure mit der Verhältnisformel AgSCN. Es kommt als weißes Pulver vor. Eine Rolle spielt es bei der Herstellung von Silbernanopartikeln.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
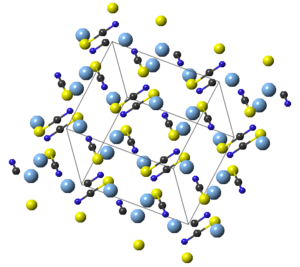
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silberthiocyanat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | AgSCN | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 165,95 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenFällungsreaktion
BearbeitenSilberthiocyanat kann durch Ausfällen gewonnen werden, indem eine Lösung von Silberionen in Salpetersäure mit Kaliumthiocyanat versetzt wird:[3]
Ionentauschreaktion
BearbeitenSilberthiocyanat kann außerdem durch eine Ionentauschreaktion hergestellt werden. Beispielsweise reagieren Silbernitrat und Ammoniumthiocyanat in Wasser gelöst dazu, als Nebenprodukt entsteht dabei Ammoniumnitrat:[4]
Eigenschaften
BearbeitenSilberberthiocyanat kristallisiert monoklin. Die SCN−-Gruppen haben eine fast lineare Molekülgeometrie mit einem Bindungswinkel von 179,6°.[5] Silberthiocyanat ist praktisch unlöslich in Wasser mit einer Löslichkeit von 1,68 · 10−4 g/L.[6]
Verwendung
BearbeitenDie wichtigste Verwendung von Silberthiocyanat ist zur Herstellung von Nanopartikeln.[6] Diese Nanopartikel können als guter Ionenleiter genutzt werden. Silberthiocyanat kann auch zu Absorption von Licht mit Wellenlänge kleiner 500 nm dienen. Bei höheren Wellenlängen zeigt es gute photokatalytische Eigenschaften.[4]
Einzelnachweise
Bearbeiten- ↑ a b c d e f Datenblatt Silberthiocyanat bei Sigma-Aldrich, abgerufen am 28. Oktober 2024 (PDF).
- ↑ a b c Anatolievich, Kiper Ruslan: silver thiocyanate. In: chemister.ru. Abgerufen am 27. Oktober 2024 (englisch).
- ↑ G. Pfrepper, R. Pfrepper, M. Knothe: Recovery of palladium and silver from process solutions by precipitation with thiocyanates and iron cyanides. In: Hydrometallurgy. Band 21, Nr. 3, Mai 1989, S. 293–304, doi:10.1016/0304-386X(89)90003-0.
- ↑ a b Shuna Zhang, Shujuan Zhang, Limin Song, Xiaoqing Wu, Sheng Fang: Synthesis and photocatalytic property of a new silver thiocyanate semiconductor. In: Chemical Engineering Journal. 1. Mai 2014, S. 24–30, doi:10.1016/j.cej.2014.01.015.
- ↑ H.-L. Zhu, G.-F. Liu, F.-J. Meng: Refinement of the crystal structure of silver(I) thiocyanate, AgSCN. In: Zeitschrift für Kristallographie – New Crystal Structures. München 2003, S. 263–264, doi:10.1524/ncrs.2003.218.jg.285 (englisch).
- ↑ a b Claudia Kästner, Alfonso Lampen, Andreas F. Thünemann: What happens to the silver ions? – Silver thiocyanate nanoparticle formation in an artificial digestion. In: Nanoscale. Band 10, Nr. 8, 2018, S. 3650–3653, doi:10.1039/C7NR08851E, PMID 29431819.

