Tantal(IV)-iodid
Tantal(IV)-iodid ist eine anorganische chemische Verbindung des Tantals aus der Gruppe der Iodide.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| _ Ta4+ _ I− | |||||||
| Allgemeines | |||||||
| Name | Tantal(IV)-iodid | ||||||
| Andere Namen |
Tantaltetraiodid | ||||||
| Verhältnisformel | TaI4 | ||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 688,57 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
reagiert mit Wasser[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Gewinnung und Darstellung
BearbeitenTantal(IV)-iodid kann durch Reaktion von Tantal(V)-iodid mit Aluminium, Magnesium oder Calcium bei 380 °C gewonnen werden. Dabei entsteht als stabiler Bodenkörper auch Ta6I14. Die Darstellung eines sehr reinen kristallisierten Tantal(IV)-iodid ist dadurch schwierig.[1]
Eigenschaften
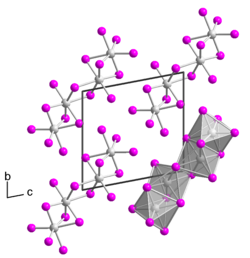
BearbeitenTantal(IV)-iodid ist ein schwarzer Feststoff. Er besitzt eine Kristallstruktur isotyp zu der von Niob(IV)-iodid.[1] Einkristallines Tantal(IV)-iodid wurde erstmals 2008 von Rafal Wiglusz und Gerd Meyer als Zufallsprodukt einer Umsetzung in einer Tantalampulle erhalten, die eigentlich zu dem Produkt Rb(Pr6C2)I12 führen sollte.[4] Das Einkristall besitzt eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2) mit zwei Formeleinheiten pro Elementarzelle (a = 707,36 pm, b = 1064,64 pm, c = 1074,99 pm, α = 100,440°, β = 89,824° und γ = 104,392°). Die Kristallstruktur unterscheidet sich von dem anderer Übergangsmetalltetraiodide, die meist eine MI4/2I2/1-Kettenstruktur besitzen, da sie aus TaI6-Oktaedern besteht, die über eine gemeinsame Fläche zu einem Dimer verbrückt sind. Zwei solcher Dimere verbrücken über eine gemeinsame Kante zu einem Tetramer.[5]
Einzelnachweise
Bearbeiten- ↑ a b c d e Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1455.
- ↑ W. M. Haynes (Hrsg.): CRC handbook of chemistry and physics. A ready-reference book of chemical and physical data. Begründet von David R. Lide. 93. Auflage. CRC Press, Boca Raton 2012, ISBN 978-1-4398-8049-4, S. 4–93 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Gerd Meyer, Rafal Wiglusz, Ingo Pantenburg, Anja-Verena Mudring: Tantalum(IV) Iodide, TaI4: A Molecular Solid Consisting of Dimers of Dimers, Ta4I16. In: Zeitschrift für anorganische und allgemeine Chemie. 634, 2008, S. 825–828, doi:10.1002/zaac.200700529.
- ↑ Katja Habermehl; Neue Untersuchungen an Halogeniden des Niobs und Tantals (PDF; 3,9 MB), urn:nbn:de:hbz:38-31032, 22. April 2010.