Uran(IV)-fluorid
Uran(IV)-fluorid (UF4), meistens Urantetrafluorid genannt, ist eine chemische Verbindung aus den Elementen Uran und Fluor. Es ist ein grüner kristalliner Feststoff und aufgrund seiner Ionenbindung ein Salz. Es ist daher als „green salt“ bekannt. Es ist in der Regel ein Zwischenprodukt bei der Umwandlung von Uranerzen zu Uranhexafluorid (UF6), das wiederum die wichtigste Grundlage für die Produktion von Brennstäben und Nuklearwaffen bildet.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
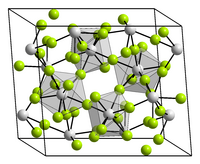
| ||||||||||||||||
| _ U4+ _ F− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
C2/c (Nr. 15) | |||||||||||||||
| Gitterparameter |
a = 1273 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Uran(IV)-fluorid | |||||||||||||||
| Andere Namen |
Urantetrafluorid | |||||||||||||||
| Verhältnisformel | UF4 | |||||||||||||||
| Kurzbeschreibung |
grüne monokline Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 314,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
6,7 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1417 °C[1] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||
 Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Darstellung
BearbeitenEs wird gebildet durch Einwirkung von Flusssäure auf Urandioxid:
oder durch Reaktion von UF6 mit Wasserstoffgas:
Sehr reines Uran(IV)-fluorid kann durch Überleiten von trockenem Dichlordifluormethan (Freon 12) über 400 °C heißes Uran(VI)-oxid erhalten werden.[6][7]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenUran(IV)-fluorid kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterparametern a = 1273 pm, b = 1075 pm, c = 843 pm, β = 126° und zwölf Formeleinheiten pro Elementarzelle.[8]
Chemische Eigenschaften
BearbeitenUran(IV)-fluorid hydrolysiert allmählich bei Kontakt mit Wasser zu Urandioxid und Flusssäure. Aufgrund dieses Verhaltens ist eine Lagerung an feuchter Luft nicht empfehlenswert, stattdessen sollte es an trockener Luft oder unter Inertgas gelagert werden.[9]
Sicherheitshinweise
BearbeitenUran(IV)-fluorid ist hochtoxisch beim Einatmen und Verschlucken. Außerdem besteht die Gefahr der Uran-Anreicherung im menschlichen Körper, was vor allem die Leber und die Nieren betrifft. Für Wasserorganismen ist es ebenfalls giftig und kann Langzeitschäden in der Wasserwelt verursachen. Wie alle Uranverbindungen ist es radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig.
Produktion
BearbeitenIn Europa wird es fast ausschließlich durch den französischen Staatskonzern Orano an dessen Standort Malvési in Narbonne hergestellt. Die jährliche Produktionsmenge betrug zu Spitzenzeiten Anfang der 2000er bis zu 14.000 t, was etwa einem Viertel des weltweiten Jahresgesamtbedarfs entsprach. Nach dem Reaktorunfall von Fukushima war die Produktion in Malvési zunächst stark rückläufig, hat sich jedoch mittlerweile wieder stabilisiert.
Ausgangsprodukt ist das meist direkt aus den Uranerzminen gelieferte Pulvergemisch Yellowcake. Das Uran(IV)-fluorid wird anschließend an einem weiteren Standort des Unternehmens zu Uranhexafluorid verarbeitet und für die Nutzung in Kernkraftwerken aufbereitet.
Literatur
Bearbeiten- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698 (doi:10.1007/1-4020-3598-5_5).
- S. Kern, J. Hayward, S. Roberts, J. W. Richardson, F. J. Rotella, L. Soderholm, B. Cort, M. Tinkle, M. West, D. Hoisington, G. H. Lander: Temperature Variation of the Structural Parameters in Actinide Tetrafluorides, in: Journal of Chemical Physics, 1994, 101, S. 9333–9337 (doi:10.1063/1.467963).
Einzelnachweise
Bearbeiten- ↑ a b c d David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-97.
- ↑ Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- ↑ E. H. P. Cordfunke, W. Ouweltjes: Standard Enthalpies of Formation of Uranium Compounds VII. UF3 and UF4 (by Solution Calorimetry), in: The Journal of Chemical Thermodynamics, 1981, 13 (2), S. 193–197 (doi:10.1016/S0021-9614(81)80025-0).
- ↑ H. S. Booth, W. Krasny-Ergen, R. E. Heath: Uranium Tetrafluoride, in: Journal of the American Chemical Society, 1946, 68 (10), S. 1969–1970 (doi:10.1021/ja01214a028).
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 261–262.
- ↑ A. C. Larson, R. B. Roof Jnr, D. T. Cromer: The Crystal Structure of UF4, in: Acta Crystallographica, 1964, 17, S. 555–558 (doi:10.1107/S0365110X64001293).
- ↑ Uranium Tetrafluoride, Appendix A of the PEIS (DOE/EIS-0269) ( vom 30. Januar 2016 im Internet Archive)


